Глава 21 Периодические тенденции и элементы s-блока
Глава 21 Периодические тенденции и s-блок элементов
В предыдущих главах мы использовали принципы химической связи, термодинамики и кинетики для создания концептуальной основы для понимания химии элементов. Начиная с главы 21 “Периодические тенденции и элементы”, мы используем периодическую таблицу для обсуждения свойств и реакций элементов, а также синтеза и применения некоторых из их коммерчески важных соединений. Мы начинаем эту главу с обзора периодических тенденций в качестве введения, а затем описываем химию водорода и других элементов s-блока. В главе 22 “The ” мы рассматриваем химию элементов p-блока; в главе 23 “The ” представлены переходные металлы, в которых заполняется d-подоболочка. В этой главе вы узнаете, почему хлорид калия используется вместо хлорида натрия в диете с низким содержанием натрия, почему цезий используется в качестве фотосенсора, почему нагревательные элементы в электрических плитах покрыты оксидом магния и почему воздействие радиоактивного изотопа стронция более опасно для детей, чем для взрослых.
Испытания пламенем. Нагревание соединения в очень горячем пламени приводит к образованию атомов его компонентов в электронно-возбужденном состоянии. Когда возбужденный атом переходит в основное состояние, он излучает свет (глава 6 “Строение атомов”). Каждый элемент излучает свет на характерных частотах. Для определения многих элементов по цвету света, излучаемого в видимой области электромагнитного спектра, используются пламенные тесты. Как показано здесь, соединения натрия излучают интенсивный желтый свет, а соединения калия – малиновый.
21.1 Обзор периодических рядов
Цель обучения
- Знать важные периодические тенденции в некоторых атомных свойствах.
Начиная обзор периодических тенденций, вспомните из главы 7 “Периодическая таблица и периодические тенденции”, что самым важным объединяющим принципом в понимании химии элементов является систематическое увеличение атомного номера, сопровождаемое упорядоченным заполнением атомных орбиталей электронами, что приводит к периодичности в таких свойствах, как атомный и ионный размер, энергия ионизации, электроотрицательность и сродство к электрону. Эти же факторы приводят к периодичности в конфигурациях валентных электронов, что для каждой группы приводит к сходству в состояниях окисления и образованию соединений с общей стехиометрией.
Наиболее важные периодические тенденции в атомных свойствах суммированы на рисунке 21.1 “Резюме периодических тенденций в атомных свойствах”. Вспомните из главы 7 “Периодическая таблица и периодические тенденции”, что эти тенденции основаны на периодических изменениях одного фундаментального элемента.Диагональная линия на рисунке 21.1 “Сводка периодических тенденций в атомных свойствах” отделяет металлы (слева от линии) от неметаллов (справа от линии). Поскольку металлы имеют относительно низкую электроотрицательность, они склонны терять электроны в химических реакциях с элементами, имеющими относительно высокую электроотрицательность, образуя соединения, в которых они имеют положительные степени окисления. Напротив, неметаллы имеют высокую электроотрицательность, и поэтому они склонны приобретать электроны в химических реакциях, образуя соединения, в которых они имеют отрицательную степень окисления. Полуметаллы лежат вдоль диагональной линии, разделяющей металлы и неметаллы. Неудивительно, что они проявляют свойства и реакционную способность, промежуточные между свойствами металлов и неметаллов. Поскольку элементы групп 13, 14 и 15 проходят по диагональной линии, разделяющей металлы и неметаллы, их химический состав более сложен, чем можно было бы предположить, основываясь только на их валентных электронных конфигурациях.Рисунок 21.1 Сводка периодических тенденций в атомных свойствах
Энергии ионизации, величины сродства к электрону и электроотрицательности обычно увеличиваются слева направо и снизу вверх. Напротив, атомный размер уменьшается слева направо и снизу вверх. Следовательно, элементы в верхней правой части периодической таблицы являются самыми маленькими и наиболее электроотрицательными; элементы в нижней левой части – самые большие и наименее электроотрицательные. Полуметаллы лежат вдоль диагональной линии, отделяющей металлы от неметаллов, и проявляют промежуточные свойства.
Уникальная химия самых легких элементов
Химия элемента второго периода каждой группы (n = 2: Li, Be, B, C, N, O и F) во многих важных отношениях отличается от химии более тяжелых членов, или сородичей, группы. Следовательно, элементы третьего периода (n = 3: Na, Mg, Al, Si, P, S и Cl) в целом более репрезентативны для группы, к которой они принадлежат. Аномальная химия элементов второго периода обусловлена тремя важными характеристиками: малыми радиусами, энергетически недоступными d-орбиталями и склонностью к образованию pi (π) связей с другими атомами.
Обратите внимание на закономерность
В отличие от химии элементов второго периода, химия элементов третьего периода более репрезентативна для химии соответствующей группы.
Из-за малых радиусов элементы второго периода имеют сродство к электрону менее отрицательное, чем можно было бы предположить, исходя из общих периодических тенденций. Когда электрон добавляется к такому маленькому атому, повышенное электрон-электронное отталкивание имеет тенденцию к дестабилизации аниона. Кроме того, малые размеры этих элементов не позволяют им образовывать соединения, в которых они имеют более четырех ближайших соседей. Таким образом, BF
образует только четырехкоординационный, тетраэдрический BF
– ион, в то время как при тех же условиях AlF3 образует шестикоординатный, октаэдрический AlF43-ион. Из-за меньшего атомного размера простые бинарные ионные соединения элементов второго периода также имеют более ковалентный характер, чем соответствующие соединения, образованные из их более тяжелых сородичей. Очень маленькие катионы, полученные из элементов второго периода, имеют высокое отношение заряда к радиусу и поэтому могут поляризовать заполненную валентную оболочку аниона. Таким образом, связь в таких соединениях имеет значительный ковалентный компонент, что придает соединениям свойства, которые могут значительно отличаться от тех, которые ожидаются для простых ионных соединений. Например, LiCl, имеющий частично ковалентный характер, гораздо лучше растворим, чем NaCl, в растворителях с относительно низкой диэлектрической проницаемостью, таких как этанол (ε = 25,3 против 80,1 для HCl).3Поскольку d-орбитали никогда не заняты для главных квантовых чисел меньше 3, валентные электроны элементов второго периода занимают только 2 s- и 2 p-орбитали. Энергия трех d-орбиталей намного превышает энергию двух s- и двух p-орбиталей, поэтому их использование в связи энергетически запрещено. Следовательно, электронные конфигурации с более чем четырьмя электронными парами вокруг центрального элемента второго периода просто не наблюдаются. Вы можете вспомнить из главы 8 “Ионная и ковалентная связь”, что роль d-орбиталей в связи в соединениях основной группы с координационными числами 5 и выше остается несколько спорной. На самом деле, теоретические описания связи в таких молекулах, как SF6 были опубликованы без упоминания участия d-орбиталей на сере. Аргументы, основанные на доступности d-орбиталей и небольшом размере центрального атома, однако, предсказывают, что координационные числа больше 4 необычны для элементов второго периода, что согласуется с экспериментальными результатами.2O).
Одним из наиболее резких различий между самыми легкими элементами главной группы и их более тяжелыми сородичами является склонность элементов второго периода к образованию видов, содержащих множественные связи. Например, N находится чуть выше P в группе 15: N6 содержит связь N≡N, но каждый атом фосфора в тетраэдрическом P
образует три связи P-P. Это различие в поведении отражает тот факт, что в пределах одной и той же группы периодической таблицы относительные энергии π-связи и сигма (σ) связи различаются. Например, связь C=C приблизительно на 80% сильнее, чем связь C-C. В отличие от этого, связь Si=Si, имеющая меньшее перекрывание p-орбиталей между валентными орбиталями связываемых атомов из-за большего размера атома, лишь на 40% прочнее связи Si-Si. Следовательно, соединения, содержащие как множественные, так и единичные связи C-C, характерны для углерода, но соединения, содержащие только сигма-связи Si-Si, энергетически более благоприятны для кремния и других элементов третьего периода.2Еще одна важная тенденция, которую следует отметить в химии основных групп, – это химическое сходство между самым легким элементом одной группы и элементом, расположенным непосредственно под ним и справа от него в следующей группе, – явление, известное как эффект диагонали (Рисунок 21.2 “Эффект диагонали”) Например, существует значительное сходство между химией Li и Mg, Be и Al, B и Si. Как BeCl4 и AlCl
имеют существенный ковалентный характер, поэтому они в некоторой степени растворимы в неполярных органических растворителях. Напротив, хотя Mg и Be находятся в одной группе, MgCl2 ведет себя как типичный ионный галогенид из-за меньшей электроотрицательности и большего размера магния.3Рисунок 21.2 Диагональный эффект2Свойства самого легкого элемента в группе часто более схожи со свойствами элементов, расположенных ниже и правее в периодической таблице. Например, химические свойства лития более схожи с химическими свойствами магния из группы 2, чем с химическими свойствами натрия, следующего элемента из группы 1.
Эффект инертной пары
Эффект инертной пары – эмпирическое наблюдение того, что более тяжелые элементы групп 13-17 часто имеют степень окисления на 2 ниже, чем максимальная, предсказанная для их группы. относится к эмпирическому наблюдению того, что более тяжелые элементы групп 13-17 часто имеют степень окисления на 2 ниже, чем максимальная, предсказанная для их группы. Например, хотя состояние окисления +3 является обычным для элементов группы 13, самый тяжелый элемент группы 13, таллий (Tl), чаще образует соединения, в которых он имеет состояние окисления +1. По-видимому, эффект инертной пары объясняется двумя основными причинами: увеличением энергии ионизации и уменьшением прочности связей.
Обратите внимание на закономерность
При движении вниз по группе в p-блоке увеличение энергии ионизации и уменьшение прочности связей приводит к эффекту инертной пары.
Из-за малых радиусов элементы второго периода имеют сродство к электрону менее отрицательное, чем можно было бы предположить, исходя из общих периодических тенденций. Когда электрон добавляется к такому маленькому атому, повышенное электрон-электронное отталкивание имеет тенденцию к дестабилизации аниона. Кроме того, малые размеры этих элементов не позволяют им образовывать соединения, в которых они имеют более четырех ближайших соседей. Таким образом, BF
Таблица 21.1 Энергии ионизации ( I ) и средние энергии связи M-Cl для элементов группы 13
Элемент
Конфигурация электронов
| I | (кДж/моль) | I 1 + I | I 1 (кДж/моль)2 (кДж/моль)3 + I | [Ne] 3 s 2 3 p 1 |
|---|---|---|---|---|
| B | [Ar] 3 d 10 4 s 2 4 p 1 | 801 | 6828 | 536 |
| Al | [Kr] 4 d 10 5 s 2 p 1 | 578 | 5139 | 494 |
| Ga | [Xe] 4 f 14 5 d 10 6 s 2 p 1 | 579 | 5521 | 481 |
| In | Источник данных: Джон А. Дин, Lange’s Handbook of Chemistry, 15th ed. (New York: McGraw-Hill, 1999). | 558 | 5083 | 439 |
| Tl | При понижении группы атомы обычно становятся крупнее, а перекрытие валентных орбиталей связанных атомов уменьшается. Следовательно, прочность связи имеет тенденцию уменьшаться вниз по колонке. Как показывают энергии связи M-Cl, перечисленные в таблице 21.1 “Энергии ионизации (“, прочность связи между атомом группы 13 и атомом хлора уменьшается более чем на 30% от B к Tl. Аналогичные уменьшения наблюдаются для атомов групп 14 и 15. | 589 | 5439 | 373 |
Чистый эффект этих двух факторов – увеличение энергии ионизации и уменьшение прочности связи – заключается в том, что при понижении группы в p-блоке дополнительная энергия, высвобождаемая при образовании двух дополнительных связей, в конечном итоге оказывается недостаточно большой, чтобы компенсировать дополнительную энергию, необходимую для удаления двух электронов ns 2.
Пример 1
Исходя из положения элементов группы 13 в периодической таблице и общих тенденций, описанных в этом разделе,
классифицируйте эти элементы как металлы, полуметаллы или неметаллы.
Предскажите, какой элемент образует наиболее устойчивые соединения в степени окисления +1.
- предскажите, какой элемент больше всего отличается от других по химическому составу.
- предсказать, какой элемент другой группы будет проявлять химические свойства, наиболее схожие с химическими свойствами Al.
- Дано: расположение элементов в периодической таблице
- Спрашивается: классификация, устойчивость в состоянии окисления и химическая реактивность
Стратегия:
На основании положения диагональной линии в периодической таблице, разделяющей металлы и неметаллы, классифицируйте элементы группы 13. Затем используйте тенденции, обсуждаемые в этом разделе, для сравнения их относительной стабильности и химической реактивности.
Решение:
Группа 13 охватывает диагональную линию, отделяющую металлы от неметаллов. Хотя Al и B лежат на диагональной линии, только B является полуметаллом; более тяжелые элементы являются металлами.
Все пять элементов группы 13 имеют валентную электронную конфигурацию ns 2 np 1, поэтому ожидается, что они образуют ионы с зарядом +3 в результате потери всех валентных электронов. Эффект инертной пары должен быть наиболее важным для самого тяжелого элемента (Tl), поэтому он, скорее всего, будет образовывать соединения в степени окисления, которая ниже на 2. Таким образом, для таллия, по прогнозам, наиболее важным будет состояние окисления +1.
- Среди элементов основной группы самый легкий член каждой группы демонстрирует уникальные химические свойства из-за своего малого размера, приводящего к высокой концентрации заряда, энергетически недоступных d-орбиталей и склонности к образованию множественных связей. Мы предсказываем, что в группе 13 химия бора будет сильно отличаться от химии его более тяжелых сородичей.
- В пределах s- и p-блоков сходство между элементами разных групп наиболее заметно между самым легким членом одной группы и элементом следующей группы, расположенным непосредственно под ним и справа от него. Эти элементы имеют сходные электроотрицательности и соотношения заряда к радиусу. Поскольку Al является вторым членом группы 13, мы предсказываем, что его химический состав будет наиболее похож на состав Be, самого легкого члена группы 2.
- На основании положения элементов группы 14 – C, Si, Ge, Sn и Pb – в периодической таблице и общих тенденций, описанных в этом разделе,
- классифицируйте эти элементы как металлы, полуметаллы или неметаллы.
предскажите, какой элемент образует наиболее устойчивые соединения в состоянии окисления +2.
- предскажите, какой элемент больше всего отличается от других по химическому составу.
- предскажите, какой элемент из группы 14 будет химически наиболее похож на элемент из группы 15.
- Дано: расположение элементов в периодической таблице
- неметалл: C; полуметаллы: Si и Ge; металлы: Sn и Pb
Pb наиболее стабилен в виде M 2+ .
- C наиболее разнообразен.
- C и P наиболее схожи по химическому составу.
- Резюме
- Наиболее важным объединяющим принципом в описании химии элементов является то, что систематическое увеличение атомного номера и упорядоченное заполнение атомных орбиталей приводит к периодическим тенденциям в атомных свойствах. Наиболее фундаментальным свойством, приводящим к периодическим изменениям, является эффективный ядерный заряд (Z
эфф
) . Из-за положения диагональной линии, разделяющей металлы и неметаллы в периодической таблице, химия групп 13, 14 и 15 относительно сложна. Элементы второго периода (n = 2) в каждой группе демонстрируют уникальные химические свойства по сравнению со своими более тяжелыми сородичами из-за меньших радиусов, энергетически недоступных d-орбиталей и большей способности образовывать π-связи с другими атомами. Увеличение энергии ионизации и уменьшение прочности связей приводит к эффекту инертной пары, из-за которого самые тяжелые элементы групп 13-17 имеют стабильное состояние окисления, которое ниже на 2, чем максимальное, предсказанное для их соответствующих групп.Основные выводыХимия элемента третьего периода в группе наиболее показательна для химии группы, поскольку в химии элементов второго периода доминируют их малые радиусы, энергетически недоступные d-орбитали и склонность к образованию π-связей с другими атомами.
Концептуальные проблемы
- Перечислите три физических свойства, которые важны для описания поведения элементов главной группы.
Расположите K, Cs, Sr, Ca, Ba и Li в порядке
возрастания энергии ионизации.
увеличение размера атома.
- увеличения электроотрицательности.
- Расположите Rb, H, Be, Na, Cs и Ca в порядке
- уменьшения размера атома.
уменьшения величины сродства к электрону.
- На какие периодические тенденции влияет Z
- eff
? Исходя из положения элементов в периодической таблице, какой элемент, по вашему мнению, будет иметь наибольший Z Диагональная линия на рисунке 21.1 “Сводка периодических тенденций в атомных свойствах” отделяет металлы (слева от линии) от неметаллов (справа от линии). Поскольку металлы имеют относительно низкую электроотрицательность, они склонны терять электроны в химических реакциях с элементами, имеющими относительно высокую электроотрицательность, образуя соединения, в которых они имеют положительные степени окисления. Напротив, неметаллы имеют высокую электроотрицательность, и поэтому они склонны приобретать электроны в химических реакциях, образуя соединения, в которых они имеют отрицательную степень окисления. Полуметаллы лежат вдоль диагональной линии, разделяющей металлы и неметаллы. Неудивительно, что они проявляют свойства и реакционную способность, промежуточные между свойствами металлов и неметаллов. Поскольку элементы групп 13, 14 и 15 проходят по диагональной линии, разделяющей металлы и неметаллы, их химический состав более сложен, чем можно было бы предположить, основываясь только на их валентных электронных конфигурациях.? самый низкий Z Диагональная линия на рисунке 21.1 “Сводка периодических тенденций в атомных свойствах” отделяет металлы (слева от линии) от неметаллов (справа от линии). Поскольку металлы имеют относительно низкую электроотрицательность, они склонны терять электроны в химических реакциях с элементами, имеющими относительно высокую электроотрицательность, образуя соединения, в которых они имеют положительные степени окисления. Напротив, неметаллы имеют высокую электроотрицательность, и поэтому они склонны приобретать электроны в химических реакциях, образуя соединения, в которых они имеют отрицательную степень окисления. Полуметаллы лежат вдоль диагональной линии, разделяющей металлы и неметаллы. Неудивительно, что они проявляют свойства и реакционную способность, промежуточные между свойствами металлов и неметаллов. Поскольку элементы групп 13, 14 и 15 проходят по диагональной линии, разделяющей металлы и неметаллы, их химический состав более сложен, чем можно было бы предположить, основываясь только на их валентных электронных конфигурациях.Сравните свойства металлов и неметаллов с точки зрения их электроотрицательности и предпочтительных состояний окисления.Диагональная линия на рисунке 21.1 “Сводка периодических тенденций в атомных свойствах” отделяет металлы (слева от линии) от неметаллов (справа от линии). Поскольку металлы имеют относительно низкую электроотрицательность, они склонны терять электроны в химических реакциях с элементами, имеющими относительно высокую электроотрицательность, образуя соединения, в которых они имеют положительные степени окисления. Напротив, неметаллы имеют высокую электроотрицательность, и поэтому они склонны приобретать электроны в химических реакциях, образуя соединения, в которых они имеют отрицательную степень окисления. Полуметаллы лежат вдоль диагональной линии, разделяющей металлы и неметаллы. Неудивительно, что они проявляют свойства и реакционную способность, промежуточные между свойствами металлов и неметаллов. Поскольку элементы групп 13, 14 и 15 проходят по диагональной линии, разделяющей металлы и неметаллы, их химический состав более сложен, чем можно было бы предположить, основываясь только на их валентных электронных конфигурациях.?
Расположите As, O, Ca, Sn, Be и Sb в порядке уменьшения металлического характера.
Назовите три причины, по которым химия элементов второго периода не является репрезентативной для их групп в целом.
Сравните элементы второго периода и их более тяжелых сородичей в отношении
величина сродства к электрону.
координационное число.
- растворимость галогенидов в неполярных растворителях.
- Более тяжелые элементы главной группы склонны образовывать протяженные структуры с сигма-связями, а не кратные связи с другими атомами. Дайте разумное объяснение этой тенденции.
- Что такое диагональный эффект? Как он объясняет сходство в химии между, например, бором и кремнием?
Хотя многие свойства элементов второго и третьего периодов в группе совершенно различны, одно свойство сходно. Какое именно?
Два элемента являются эффективными добавками к твердому ракетному топливу: бериллий и еще один элемент с похожим химическим составом. Исходя из положения бериллия в периодической таблице, определите второй элемент.
Назовите две причины эффекта инертной пары. Как это явление объясняет, почему Sn 2+ является лучшим восстановителем, чем Pb 2+?
Объясните следующую тенденцию в сродстве к электрону: Al (-41,8 кДж/моль), Si (-134,1 кДж/моль), P (-72,0 кДж/моль) и S (-200,4 кДж/моль).
Используя аргументы орбитальной энергии, объясните, почему электронные конфигурации с более чем четырьмя электронными парами вокруг центрального атома не наблюдаются у элементов второго периода.
Ответы
Be
Величина сродства к электрону увеличивается слева направо в периоде из-за увеличения Z
- Cs > Rb > Ca > Na > Be > H
- H > Na > Rb > Cs > Ca >eff
Ca > Be > Sn > Sb > As > O
; P имеет более низкое сродство к электрону, чем ожидалось, из-за наполовину заполненной 3 p оболочки, что требует, чтобы добавленный электрон вошел в уже занятую 3 p орбиталь.Диагональная линия на рисунке 21.1 “Сводка периодических тенденций в атомных свойствах” отделяет металлы (слева от линии) от неметаллов (справа от линии). Поскольку металлы имеют относительно низкую электроотрицательность, они склонны терять электроны в химических реакциях с элементами, имеющими относительно высокую электроотрицательность, образуя соединения, в которых они имеют положительные степени окисления. Напротив, неметаллы имеют высокую электроотрицательность, и поэтому они склонны приобретать электроны в химических реакциях, образуя соединения, в которых они имеют отрицательную степень окисления. Полуметаллы лежат вдоль диагональной линии, разделяющей металлы и неметаллы. Неудивительно, что они проявляют свойства и реакционную способность, промежуточные между свойствами металлов и неметаллов. Поскольку элементы групп 13, 14 и 15 проходят по диагональной линии, разделяющей металлы и неметаллы, их химический состав более сложен, чем можно было бы предположить, основываясь только на их валентных электронных конфигурациях.В следующей таблице приведены валентности, координационные числа и ионные радиусы для ряда катионов. Какой из них вы бы заменили на K+ в кристаллической решетке? Объясните свой ответ.
Металл
Заряд
| Координационное число | Ионный радиус (пм) | Ответ | Sr 2+ ; это ион с радиусом, наиболее близким к радиусу K+ . |
|---|---|---|---|
| Li | +1 | 4 | 76 |
| Na | +1 | 6 | 102 |
| K | +1 | 6 | 138 |
| Mg | +2 | 6 | 72 |
| Ca | +2 | 6 | 100 |
| Sr | +2 | 6 | 118 |
21.2 Химия водорода
Цель обучения
Описать физические и химические свойства водорода и предсказать его реакционную способность.
Цель обучения
- Обратите внимание на схему
Хотя водород имеет электронную конфигурацию ns 1, его химический состав не похож на состав металлов первой группы.
Из-за малых радиусов элементы второго периода имеют сродство к электрону менее отрицательное, чем можно было бы предположить, исходя из общих периодических тенденций. Когда электрон добавляется к такому маленькому атому, повышенное электрон-электронное отталкивание имеет тенденцию к дестабилизации аниона. Кроме того, малые размеры этих элементов не позволяют им образовывать соединения, в которых они имеют более четырех ближайших соседей. Таким образом, BF
Водород, самый распространенный элемент во Вселенной, является конечным источником всех других элементов в процессе ядерного синтеза. (Подробнее о ядерном синтезе см. главу 20 “Ядерная химия”). В таблице 21.2 “Изотопы водорода” сравниваются три изотопа водорода, каждый из которых содержит один протон и один электрон на атом. Наиболее распространенным изотопом является протий Самый распространенный изотоп водорода, состоящий из одного протона и одного электрона. ( 1 H или H), за которым следует дейтерий Изотоп водорода, состоящий из одного протона, одного нейтрона и одного электрона. ( 2 H или D), который имеет дополнительный нейтрон. Самый редкий изотоп водорода – тритий Редкий изотоп водорода, состоящий из одного протона, двух нейтронов и одного электрона. ( 3 H или T), который образуется в верхних слоях атмосферы в результате ядерной реакции, когда космические лучи ударяют в азот и другие атомы; затем он вымывается в океаны в виде осадков. Тритий радиоактивен и распадается до 3 He с периодом полураспада всего 12,32 года. Следовательно, атмосфера и океаны содержат лишь очень низкий, стабильный уровень трития. Термин “водород” и символ H обычно относятся к встречающейся в природе смеси трех изотопов.
Таблица 21.2 Изотопы водорода
Протий
Дейтерий
| Тритий | символ | H 1 1 | |
|---|---|---|---|
| H 1 2 | H 1 3 | нейтроны | масса (amu) |
| 1.00783 | 0 | 1 | 2 |
| 2.0140 | 3.01605 | обилие (%) | 99.9885 |
| 0.0115 | ∼1 0-17 | период полураспада (годы) | 12.32 |
| температура кипения X | — | — | (K) |
| 20.28223.67 | температура плавления/температура кипения X | O (°C) | 25 |
| 0.0/100.023.8/101.4 | 4.5/? | Различные массы трех изотопов водорода обуславливают их различные физические свойства. Таким образом, H | , и T |
различаются по температурам плавления, кипения, плотности, теплотам плавления и испарения. В 1931 году Гарольд Урей и его коллеги открыли дейтерий, медленно испаряя несколько литров жидкого водорода, пока не остался объем около 1 мл. Когда оставшуюся жидкость испарили и исследовали ее эмиссионный спектр, они заметили новые линии поглощения в дополнение к тем, которые ранее были идентифицированы как происходящие от водорода. Естественное содержание трития, напротив, настолько мало, что его невозможно обнаружить с помощью подобных экспериментов; впервые он был получен в 1934 году в результате ядерной реакции.2, D2Гарольд Урей (1893-1981)2Урей получил Нобелевскую премию по химии в 1934 году за открытие дейтерия ( 2 H). Урей родился и получил образование в сельской местности штата Индиана. Получив степень бакалавра зоологии в Университете Монтаны в 1917 году, Урей сменил направление карьеры. Он получил докторскую степень по химии в Беркли вместе с Г. Н. Льюисом (известным своей электронной структурой Льюиса) и впоследствии работал с Нильсом Бором в Копенгагене. Во время Второй мировой войны Урей был директором военных исследований по проекту создания атомной бомбы в Колумбийском университете. В последующие годы его исследования были посвящены эволюции жизни. В 1953 году он и его аспирант Стэнли Миллер показали, что органические соединения, включая аминокислоты, могут образовываться при прохождении электрического разряда через смесь соединений, которые, как считалось, присутствовали в атмосфере первобытной Земли.
Поскольку нормальная температура кипения D
O составляет 101,4°C (по сравнению с 100,0°C для H
O), испарение или дробная дистилляция могут быть использованы для увеличения концентрации дейтерия в образце воды путем селективного удаления более летучей H2O. Таким образом, водоемы, не имеющие выхода, такие как Большое соленое озеро и Мертвое море, которые поддерживают свой уровень исключительно за счет испарения, имеют значительно более высокую концентрацию дейтерированной воды, чем озерная или морская вода, имеющая хотя бы один выход. Более эффективным способом получения воды с высоким содержанием дейтерия является длительный электролиз водного раствора. Поскольку масса дейтрона (D+ ) в два раза больше массы протона (H+ ), он медленнее диффундирует к поверхности электрода. Следовательно, газ, выделяющийся на катоде, обогащен H – видом, который диффундирует быстрее, что благоприятствует образованию H2 а не D2 или HD. Тем временем раствор становится обогащенным дейтерием. Богатую дейтерием воду называют тяжелой водой, поскольку плотность D2O (1,1044 г/см 3 при 25°C) больше, чем у H2O (0,99978 г/см 3). Тяжелая вода была важным компонентом ранних ядерных реакторов. (Более подробную информацию о ядерных реакторах см. в главе 20 “Ядерная химия”).2Поскольку дейтроны диффундируют гораздо медленнее, D2O не может поддерживать жизнь и является фактически токсичным при употреблении в больших количествах для млекопитающих. Лимитирующий шаг во многих важных реакциях, катализируемых ферментами, включает перенос протонов. Перенос D+ происходит так медленно по сравнению с переносом H+, потому что связи с D разрушаются медленнее, чем с H, поэтому хрупкий баланс реакций в клетке нарушается. Тем не менее, дейтерий и тритий являются важными исследовательскими инструментами для биохимиков. Встраивая эти изотопы в определенные места в выбранных молекулах, где они действуют как метки, или трассеры, биохимики могут проследить путь молекулы через организм или клетку. Трейсеры также могут быть использованы для получения информации о механизме ферментативных реакций.
Связь в водороде и водородсодержащих соединениях2Электронная конфигурация водорода 1 s 1 указывает на наличие одного валентного электрона. Поскольку орбиталь 1 s имеет максимальную емкость в два электрона, водород может образовывать соединения с другими элементами тремя способами (рис. 21.3 “Три типа связи в соединениях водорода”):
Теряет свой электрон, образуя протон (H + ) с пустой 1 s орбиталью. Протон является кислотой Льюиса, которая может принять пару электронов от другого атома для образования электронно-парной связи. Например, в кислотно-основных реакциях, обсуждаемых в главе 16 “Водные кислотно-основные равновесия”, протон всегда связывается с одинокой парой электронов на атоме в другой молекуле с образованием полярной ковалентной связи. Если одинокая пара электронов принадлежит атому кислорода молекулы воды, то в результате образуется ион гидрония (H
Принятие электрона с образованием гидрид-иона Анион образуется, когда атом водорода принимает электрон. (H – ), который имеет заполненную 1 s 2 орбиталь. Водород реагирует с относительно электроположительными металлами, такими как щелочные металлы (группа 1) и щелочноземельные металлы (группа 2), образуя ионные гидриды, которые содержат катионы металлов и H – ионы.
- Делится своим электроном с электроном другого атома, образуя электронно-парную связь. Имея наполовину заполненную орбиталь 1 s 1, атом водорода может взаимодействовать с однократно занятыми орбиталями других атомов, образуя ковалентную или полярную ковалентную электронно-парную связь, в зависимости от электроотрицательности другого атома.3O + ).
- Рисунок 21.3 Три типа связей в соединениях водорода
- Из-за своей электронной конфигурации 1 s 1 и того факта, что на 1 s орбитали может разместиться не более двух электронов, водород может (a) соединяться с другими элементами, теряя электрон с образованием протона, который может принять пару электронов от более электроотрицательного атома с образованием полярной ковалентной связи; (b) получить электрон от электроположительного металла для образования гидрид-иона, что приводит к образованию ионного гидрида; или (c) поделиться своей наполовину заполненной орбиталью 1 s с наполовину заполненной орбиталью другого атома для образования ковалентной или полярной ковалентной связи с электронной парой.
Водород также может действовать как мост между двумя атомами. Одним из знакомых примеров является водородная связь – необычайно сильное диполь-дипольное взаимодействие (межмолекулярная сила), которое возникает, когда H связан с очень электроотрицательными элементами, такими как O, N и F. Это электростатическое взаимодействие между водородом, связанным с электроотрицательным атомом, и атомом, имеющим одну или несколько одиноких пар электронов (Рисунок 21.4 “Водородная связь”). Примером такого взаимодействия является сеть водородных связей, обнаруженная в воде (Рисунок 11.8 “Водородно-связанная структура льда”). Водород также может образовывать трехцентровые связи (или электронно-дефицитные связи) – связи, в которых гидрид-ион соединяет два электроположительных атома. Связь, в которой гидрид соединяет два электроположительных атома. Соединения, содержащие водород, связанный с бором и подобными элементами, часто имеют такой тип связи. Единицы B-H-B, встречающиеся в гидридах бора, не могут быть описаны в терминах локализованных электронно-парных связей. Поскольку атом Н в центре такой единицы может разместить максимум только два электрона на своей орбитали 1 s, единица B-H-B может быть описана как содержащая гидрид, который взаимодействует одновременно с пустыми орбиталями sp 3 на двух атомах бора (рис. 21.5 “Трехцентровая связь использует два электрона для связи трех атомов”). В таких связях для удержания трех атомов вместе используются только два связывающих электрона, что делает их электронно-дефицитными связями. Вы сталкивались с подобным явлением при обсуждении π-связи в озоне и нитрит-ионе в главе 9 “Молекулярная геометрия и модели ковалентной связи”, раздел 9.4 “Многоатомные системы с множественными связями”. Напомним, что в обоих случаях мы использовали наличие двух электронов на π-молекулярной орбитали, простирающейся на три атома, для объяснения того факта, что расстояния между двумя связями O-O в озоне и двумя связями N-O в нитрите одинаковы, что иначе можно объяснить только с помощью резонансных структур.
Рисунок 21.4 Водородная связь
Ковалентная связь между водородом и очень электроотрицательным элементом, таким как азот, кислород или фтор, является высокополярной. Возникающий частичный положительный заряд на H позволяет ему взаимодействовать с одинокой парой электронов на другом атоме, образуя водородную связь, которая обычно представляет собой линейное расположение трех атомов, причем атом водорода располагается асимметрично между двумя более тяжелыми атомами.
Рисунок 21.5 Трехцентровая связь использует два электрона для соединения трех атомов
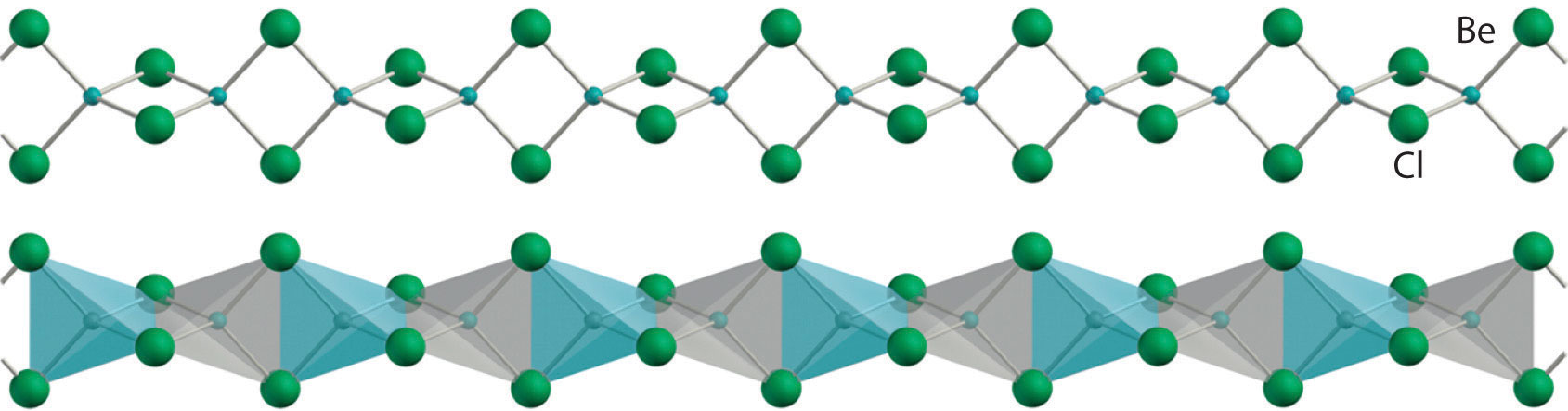
В показанном на рисунке соединении B-H-B гидрид с заполненной 1 s орбиталью одновременно взаимодействует с пустыми sp 3 гибридами на атомах бора двух единиц BH
образуя три молекулярные орбитали. Два связывающих электрона занимают самую низкоэнергетическую (σ) орбиталь связи, удерживая тем самым все три атома вместе.
Обратите внимание на схему3Водород может потерять электрон с образованием H + , принять электрон с образованием H – , поделиться своим электроном, образовать водородную связь или трехцентровую связь.
Из-за малых радиусов элементы второго периода имеют сродство к электрону менее отрицательное, чем можно было бы предположить, исходя из общих периодических тенденций. Когда электрон добавляется к такому маленькому атому, повышенное электрон-электронное отталкивание имеет тенденцию к дестабилизации аниона. Кроме того, малые размеры этих элементов не позволяют им образовывать соединения, в которых они имеют более четырех ближайших соседей. Таким образом, BF
Первое известное получение элементарного водорода произошло в 1671 году, когда Роберт Бойль растворил железо в разбавленной кислоте и получил бесцветный газообразный продукт без запаха. Окончательно водород был идентифицирован как элемент в 1766 году, когда Генри Кавендиш показал, что вода является единственным продуктом реакции этого газа с кислородом. Взрывные свойства смесей водорода с воздухом были открыты только в начале XVIII века; они частично стали причиной впечатляющего взрыва наполненного водородом дирижабля “Гинденбург” в 1937 году (рис. 21.6 “Взрывные свойства водорода”). Из-за чрезвычайно низкой молекулярной массы газообразный водород трудно конденсировать в жидкость (температура кипения = 20,3 К), а твердый водород имеет одну из самых низких известных температур плавления (13,8 К).
Рисунок 21.6 Взрывчатые свойства водорода
При смешивании с воздухом и воспламенении от искры водородный газ может взорваться. На фотографии изображен немецкий дирижабль “Гинденбург”, горящий в Лейкхерсте, Нью-Джерси, в 1937 году, после того, как его водородный отсек случайно воспламенился в результате электрического разряда, вызвавшего возгорание легковоспламеняющейся обшивки дирижабля.
Наиболее распространенный способ получения небольшого количества высокочистого водородного газа в лаборатории был открыт Бойлем: реакция активного металла (M), такого как железо, магний или цинк, с разбавленной кислотой:
M(s) + 2H + (aq) → H
(g) + M 2+ (aq)
Водородный газ также может образовываться при реакции таких металлов, как алюминий или цинк, с сильным основанием:2Al(s) + OH – (aq) + 3 H 2 O (l) → 3 2 H 2 (g) + [ Al(OH) 4 ] – (aq)
Твердые коммерческие средства для чистки канализации, такие как Drano, используют эту реакцию для образования пузырьков газа, которые помогают разрушить засоры в водосточной трубе. (Более подробную информацию об окислительно-восстановительных реакциях, подобных реакции Drano, см. в главе 19 “Электрохимия”, раздел 19.2 “Стандартные потенциалы”). Водородный газ также образуется при реакции ионных гидридов с водой. Однако, поскольку ионные гидриды дороги, эта реакция обычно используется только для специальных целей, например, для получения газа HD путем реакции гидрида с D
MH(s) + D
O(l) → HD(g) + M + (aq) + OD – (aq).2O:
В промышленных масштабах H2 производится из метана с помощью каталитического парового риформинга, метода, используемого для преобразования углеводородов в смесь CO и H
известную как синтез-газ, или сингаз. (Более подробную информацию о паровом риформинге см. в главе 14 “Химическая кинетика”, раздел 14.8 “Катализ”). Процесс осуществляется при повышенной температуре (800°C) в присутствии никелевого катализатора:2CH 4 (г) + H 2 O (г) → Ni CO (г) + 3 H 2 (г).2Большинство элементов в периодической таблице образуют бинарные соединения с водородом, которые в совокупности называются гидридами. Бинарные гидриды, в свою очередь, можно классифицировать одним из трех способов, каждый из которых имеет свои характерные свойства. Ковалентные гидриды содержат водород, соединенный с другим атомом ковалентной или полярной ковалентной связью. Ковалентные гидриды обычно представляют собой молекулярные вещества, которые относительно летучи и имеют низкие температуры плавления. Ионные гидриды содержат
(g) и родительского металла после нагревания. Металлические гидриды образуются из водорода и менее электроположительных металлов, таких как переходные металлы. Свойства металлических гидридов обычно аналогичны свойствам родительского металла. Следовательно, металлические гидриды лучше всего рассматривать как металлы, которые содержат много атомов водорода, присутствующих в качестве междоузельных примесей.
Обратите внимание на схему2Ковалентные гидриды относительно летучи и имеют низкие температуры плавления; ионные гидриды, как правило, нелетучие твердые вещества в решетчатом каркасе.
Из-за малых радиусов элементы второго периода имеют сродство к электрону менее отрицательное, чем можно было бы предположить, исходя из общих периодических тенденций. Когда электрон добавляется к такому маленькому атому, повышенное электрон-электронное отталкивание имеет тенденцию к дестабилизации аниона. Кроме того, малые размеры этих элементов не позволяют им образовывать соединения, в которых они имеют более четырех ближайших соседей. Таким образом, BF
Три изотопа водорода – протий (1 H или H), дейтерий (2 H или D) и тритий (3 H или T) – обладают различными физическими свойствами. Дейтерий и тритий могут использоваться в качестве трассеров – веществ, позволяющих биохимикам проследить путь молекулы через организм или клетку. Водород может образовывать соединения, содержащие протон (H + ), гидрид-ион (H – ), электронно-парную связь с H, водородную связь или трехцентровую связь (или электронно-дефицитную связь), в которой два электрона делятся между тремя атомами. Водородный газ может быть получен в результате реакции активного металла с разбавленной кислотой, реакции Al или Zn с сильным основанием или промышленным способом – каталитическим паровым риформингом, в результате которого образуется синтез-газ, или сингаз.
эфф
Водород может терять электрон, образуя протон, приобретать электрон, образуя гидрид-ион, или образовывать ковалентную связь или полярную ковалентную связь электрон-пара.
Концептуальные проблемы
- В некоторых периодических таблицах водород относится к элементам первой группы, в то время как в других периодических таблицах он относится к элементам 17 группы. Обратитесь к свойствам водорода, чтобы предложить объяснение его размещения в каждой группе. В каждом случае укажите одно свойство водорода, которое исключает его из групп 1 и 17.
Расположите K, Cs, Sr, Ca, Ba и Li в порядке
O и H
O, а жизнь эволюционировала, чтобы приспособиться к этой разнице, каковы были бы последствия потребления большого количества H2Опишите связи в водородной связи и центральную связь B-H в B2 – . Почему соединения, содержащие изолированные протоны, неизвестны?2O?
С какими элементами водород образует ионные гидриды? ковалентные гидриды? металлические гидриды? Какие из этих типов гидридов могут вести себя как кислоты?2H7Укажите, какие элементы, скорее всего, образуют ионные, ковалентные или металлические гидриды, и объясните свои доводы:
Что имеет более высокую энергию ионизации – H или H – ? Почему?
Электроотрицательность водорода, фтора и йода составляет 2,20, 3,98 и 2,66 соответственно. Почему тогда HI является более сильной кислотой, чем HF?
Если бы H
O была линейной молекулой, плотность льда была бы меньше или больше плотности жидкой воды? Объясните свой ответ.
Помимо ион-дипольных притяжений, водородная связь важна в твердых кристаллических гидратах, таких как Na2XeO
-8H4O. Исходя из этого утверждения, объясните, почему безводный Na6XeO2 не существует.4O. Исходя из этого утверждения, объясните, почему безводный Na6H имеет один электрон на s-орбитали, как и металлы первой группы, но ему также не хватает одного электрона для заполнения основной оболочки, как у элементов 17 группы. В отличие от щелочных металлов, водород не является металлом. В отличие от галогенов, элементарный водород не является сильным окислителем.
Величина сродства к электрону увеличивается слева направо в периоде из-за увеличения Z
ковалентный; является полуметаллом.
- ковалентный; неметалл.
- ионный; это щелочной металл.
- ковалентный; полуметалл.
- ковалентный; является щелочноземельным металлом 2-го периода.
- ионный; это щелочной металл.
- ковалентный; это металл 13 группы.
- Водородная связь с водами гидратации частично нейтрализует отрицательный заряд на концевых атомах кислорода на ионе XeO
- 4- иона, что стабилизирует твердое вещество.
Структура и реакционная способность6Одно из самых больших применений метана – получение сингаза, который является источником водорода для преобразования азота в аммиак. Напишите полное уравнение для образования сингаза из метана и диоксида углерода. Рассчитайте Δ G ° для этой реакции при 298 K и определите температуру, при которой реакция становится спонтанной.
Металл
Используйте главу 25 “Приложение A: Стандартные термодинамические величины для химических веществ при 25°C”, чтобы рассчитать Δ G ° для этой реакции при 298 K и определить температуру, при которой реакция переходит из спонтанной в неспонтанную (или наоборот).
Предскажите продукты каждой реакции при 25°C, а затем уравновесьте каждое химическое уравнение.
Используя тяжелую воду (D
O) в качестве источника дейтерия, как вы могли бы удобно приготовить
Какие продукты получаются в результате реакции NaH с D2O? Ожидаете ли вы получить такие же продукты при реакции NaD и H
O? Объясните свой ответ.2Образец металлического цинка массой 2,50 г реагирует со 100,0 мл 0,150 М HCl. Какой объем H2 (в литрах) образуется при 23°C и 729 мм рт. ст.
Для химической реакции требуется 16,8 л H2 газа при стандартной температуре и давлении. Сколько граммов металлического магния необходимо для получения этого количества газообразного водорода?
Морская вода содержит 3,5% растворенных солей по массе и имеет среднюю плотность 1,026 г/мл. Объем океана оценивается в 1,35 × 10 21 л. Используя данные таблицы 21.2 “Изотопы водорода”, рассчитайте общую массу дейтерия в океане.2По данным таблицы 21.2 “Изотопы водорода” определите молярность DOH в воде. Ожидаете ли вы, что молярность D
O в воде будет такой же? Почему или почему нет?
На основании данных таблицы 21.2 “Изотопы водорода” рассчитайте, сколько литров воды нужно испарить, чтобы получить 1,0 мл ТОД (тритий-кислород-дейтерий). Плотность ТОД составляет 1,159 г/мл.221.3 Щелочные металлы (группа 1)
Цели обучения
Описать, как выделяют щелочные металлы.
Ознакомиться с реакциями, соединениями и комплексами щелочных металлов.
- Щелочные металлы настолько реакционноспособны, что никогда не встречаются в природе в элементарной форме. Хотя некоторые из них встречаются в рудах в изобилии, выделить их из руды довольно сложно. По этим причинам элементы первой группы были неизвестны до начала 19 века, когда сэр Хамфри Дэви впервые получил натрий (Na) и калий (K), пропустив электрический ток через расплавленные щелочи. (Пепел, образующийся при сгорании древесины, в значительной степени состоит из карбоната калия и натрия). Литий (Li) был открыт 10 лет спустя, когда шведский химик Йохан Арфведсон изучал состав нового бразильского минерала. Цезий (Cs) и рубидий (Rb) были открыты только в 1860-х годах, когда Роберт Бунзен проводил систематический поиск новых элементов. Известный студентам-химикам как изобретатель горелки Бунзена, Бунзен при спектроскопическом исследовании руд обнаружил небесно-голубые и темно-красные эмиссионные линии, которые он отнес к двум новым элементам, Cs и Rb, соответственно. Франций (Fr) встречается в природе лишь в следовых количествах, поэтому наши знания о его химии ограничены. Все изотопы Fr имеют очень короткий период полураспада, в отличие от других элементов группы 1.
- Сэр Хамфри Дэви (1778-1829)
Дэви родился в Пензансе, Корнуолл, Англия. Он был немного диким человеком в лаборатории, часто нюхал и пробовал на вкус продукты своих экспериментов, что почти наверняка сократило его жизнь. Он открыл физиологические эффекты, из-за которых закись азота называют “веселящим газом” (и пристрастился к нему!), и чуть не потерял зрение при взрыве трихлорида азота (NCl).
), который он первым приготовил. Дэви был одним из первых, кто признал полезность “электрических свай” (батарей) Алессандро Вольта. Соединив несколько “свай” последовательно и вставив электроды в расплавленные соли щелочных и щелочноземельных металлов, он смог выделить шесть ранее неизвестных элементов в виде чистых металлов: натрий, калий, кальций, стронций, барий и магний. Он также открыл бор и первым приготовил фосфин (PH
) и теллурид водорода (H3Te), оба из которых очень токсичны.3Роберт Вильгельм Бунзен (1811-1899)2Бунзен родился и получил образование в Геттингене, Германия. Его ранние работы были связаны с органическими соединениями мышьяка, высокотоксичная природа и взрывоопасность которых чуть не убила его и стоила ему глаза. Он сконструировал горелку Бунзена, надежную газовую горелку, и использовал ее и эмиссионные спектры для открытия цезия (названного по синей линии) и рубидия (названного по красной линии).
Получение щелочных металлов
Поскольку щелочные металлы являются одними из самых мощных известных восстановителей, их получение в чистом виде требует значительных затрат энергии. Чистые литий и натрий, например, обычно получают путем электролитического восстановления расплавленных хлоридов:
LiCl(l) → Li(l) + 1 2 Cl 2 (g).
На практике CaCl
смешивается с LiCl для снижения температуры плавления соли лития. Электролиз проводится в атмосфере аргона, а не азота, которая обычно используется для веществ, сильно реагирующих с O
и водой, поскольку Li реагирует с газообразным азотом с образованием нитрида лития (Li2N). Металлический натрий получают электролизом расплавленной смеси NaCl и CaCl.2. Напротив, калий производится промышленным способом из восстановления KCl с помощью Na с последующей дробной дистилляцией K(g). Хотя рубидий и цезий также могут быть получены электролизом, обычно их получают путем реакции их гидроксидных солей с восстановителем, таким как Mg:32RbOH(s) + Mg(s) → 2Rb(l) + Mg(OH)2(s)
Массивные залежи практически чистых NaCl и KCl встречаются в природе и являются основными источниками натрия и калия. Другие щелочные металлы встречаются в низких концентрациях в самых разных минералах, но руды, содержащие высокие концентрации этих элементов, относительно редки. Например, не известно ни одного концентрированного источника рубидия, хотя он является 16-м по распространенности элементом на Земле. Рубидий получают в промышленных масштабах путем выделения 2%-4% Rb, присутствующего в качестве примеси в слюдах – минералах, состоящих из листов сложных гидратированных калий-алюминиевых силикатов.2Щелочные металлы извлекаются из силикатных руд в ходе многоступенчатого процесса, который использует преимущества растворимости отдельных солей каждого иона металла в зависимости от рН. Этапы этого процесса включают выщелачивание, при котором используется серная кислота для растворения нужного иона щелочного металла и Al 3+ из руды; основное осаждение для удаления Al 3+ из смеси в виде Al(OH).
; селективное осаждение нерастворимого карбоната щелочного металла; повторное растворение соли в соляной кислоте; выделение металла выпариванием и электролизом. Рисунок 21.7 “Изолирование лития из сподумена, литиевой силикатной руды” иллюстрирует выделение жидкого лития из литиевой силикатной руды с помощью этого процесса.
Рисунок 21.7 Выделение лития из сподумена, силикатной литиевой руды3Ключевыми этапами являются кислотное выщелачивание, основное осаждение гидроксида алюминия, селективное осаждение нерастворимого карбоната лития, преобразование в хлорид лития, выпаривание и электролиз. Другие щелочные и щелочноземельные металлы извлекаются из своих руд аналогичными процессами.
Общие свойства щелочных металлов
Различные свойства элементов группы 1 обобщены в таблице 21.3 “Избранные свойства элементов группы 1”. В соответствии с общими периодическими тенденциями, атомные и ионные радиусы плавно увеличиваются от Li к Cs, а энергии первой ионизации уменьшаются по мере увеличения размеров атомов. В результате низкой энергии первой ионизации щелочные металлы имеют подавляющую тенденцию к образованию ионных соединений, в которых они имеют заряд +1. Все щелочные металлы имеют относительно высокое сродство к электрону, поскольку при присоединении электрона образуется анион (M – ) с электронной конфигурацией ns 2. Плотность элементов обычно увеличивается от Li к Cs, что отражает еще одну общую тенденцию: поскольку атомные массы элементов увеличиваются быстрее, чем атомные объемы, по мере продвижения вниз по группе, самые плотные элементы находятся в нижней части периодической таблицы. Необычной тенденцией для элементов первой группы является плавное снижение точек плавления и кипения от Li к Cs. В результате Cs (температура плавления = 28,5°C) является одним из трех металлов (другие – Ga и Hg), которые являются жидкостями при температуре тела (37°C).
Таблица 21.3 Избранные свойства элементов группы 1
Литий
Натрий
| Калий | Рубидий | Цезий | Франций | атомный символ | атомный номер | |
|---|---|---|---|---|---|---|
| атомная масса | Li | Na | K | Rb | Cs | Fr |
| 6.94 | 3 | 11 | 19 | 37 | 55 | 87 |
| 22.99 | 39.10 | 85.47 | 132.91 | конфигурация валентного электрона | 2 s 1 | 223 |
| 3 s 1 | 4 s 1 | 5 s 1 | 6 s 1 | 7 s 1 | температура плавления/кипения (°C) | 180.5/1342 |
| 97.8/883 | 63.5/759 | 39.3/688 | 28.5/671 | 27/- | плотность (г/см 3 ) при 25°C | 0.534 |
| 0.97 | 0.89 | 1.53 | 1.93 | атомный радиус (пм) | энергия первой ионизации (кДж/моль) | — |
| наиболее распространенное состояние окисления | 167 | 190 | 243 | 265 | 298 | — |
| ионный радиус (пм)* | 520 | 496 | 419 | 403 | 376 | 393 |
| сродство к электрону (кДж/моль) | +1 | +1 | +1 | +1 | +1 | +1 |
| -60 | 76 | 102 | 138 | 152 | 167 | — |
| -53 | -48 | -47 | -46 | электроотрицательность | стандартный электродный потенциал ( E °, В) | — |
| -3.04 | 1.0 | 0.9 | 0.8 | 0.8 | 0.8 | 0.7 |
| -2.71 | -2.93 | -2.98 | -3.03 | продукт реакции с O | RbO | — |
| CsO2 | Li2O | Na2O2 | KO2 | тип оксида2 | основной2 | — |
| основной | основной | основной | основной | основной | основной | — |
| нет2 | Li3N | нет | нет | нет | нет | — |
| NaX2 | RbX | CsX | KX | продукт реакции с H | LiH | — |
| NaH2 | RbH | CsH | KH | * Значения приведены для четырехкоординированных ионов, за исключением Rb + и Cs + , значения которых приведены для шестикоординированного иона. | Стандартные восстановительные потенциалы ( E °) щелочных металлов не следуют тенденции, основанной на энергиях ионизации. (Более подробную информацию о восстановительных потенциалах см. в главе 19 “Электрохимия”). Неожиданно литий является самым сильным восстановителем, а натрий – самым слабым (табл. 21.3 “Избранные свойства элементов группы 1”). Поскольку Li+ намного меньше, чем другие катионы щелочных металлов, его энергия гидратации самая высокая. Высокая энергия гидратации Li+ более чем компенсирует его более высокую энергию ионизации, делая металлический литий самым сильным восстановителем в водном растворе. Эта очевидная аномалия является примером того, как физическое или химическое поведение элементов в группе часто определяется тонким взаимодействием противоположных периодических тенденций. | — |
| Реакции и соединения щелочных металлов | ||||||
Все щелочные металлы являются электроположительными элементами с конфигурацией валентных электронов ns 1, образуя монокатион (M + ) путем потери одного валентного электрона. Поскольку удаление второго электрона потребовало бы проникновения в закрытую оболочку (n – 1), что энергетически запрещено, химия щелочных металлов в основном представляет собой ионные соединения, содержащие ионы M +. Однако, как мы обсудим позже, более легкие элементы первой группы также образуют ряд металлоорганических соединений, содержащих полярные ковалентные связи M-C.
Все щелочные металлы бурно реагируют с галогенами (группа 17) с образованием соответствующих ионных галогенидов, где X – галоген:
2M(s) + X
(s, l, g) → 2M + X – (s).
Аналогично, щелочные металлы реагируют с более тяжелыми халькогенами (сера, селен и теллур в группе 16) с образованием халькогенидов металлов, где Y – S, Se или Te:2Однако при использовании избытка халькогена можно получить различные продукты, содержащие цепочки атомов халькогена, например, полисульфиды натрия (Na
n
, где n = 2-6). Например, Na2S содержит S 2- ион, который имеет V-образную форму с углом S-S-S около 103°. Одноэлектронный продукт окисления трисульфидного иона (S2S3 – ) отвечает за интенсивный синий цвет драгоценных камней лазурита и ультрамарина (Рисунок 21.8 “Трисульфидный анион отвечает за глубокий синий цвет некоторых драгоценных камней”).3Рисунок 21.8 Трисульфидный анион отвечает за глубокий синий цвет некоторых драгоценных камней3(a) Насыщенный синий цвет лазурита обусловлен небольшим количеством обычно нестабильного аниона S
– аниона. (b) Алюмосиликатные оболочки минералов (цеолитов), составляющих матрицу голубого ультрамарина, стабилизируют реактивный анион; избыток ионов Na+ в структуре уравновешивает отрицательные заряды на цеолитовом каркасе и анионе S
– анион.3Реакция щелочных металлов с кислородом, самым легким элементом группы 16, является более сложной, и стехиометрия продукта зависит как от соотношения металл:кислород, так и от размера атома металла. Например, при горении щелочных металлов на воздухе наблюдаются такие продукты, как Li3O (белый), Na
(бледно-желтый), KO2 (оранжевый), RbO2O2 (коричневый) и CsO2 (оранжевый). Только Li2O имеет2– (супероксид) ион. Поскольку O 2- самый маленький из трех анионов кислорода, он образует устойчивую ионную решетку с самым маленьким катионом щелочного металла (Li + ). Напротив, более крупные щелочные металлы – калий, рубидий и цезий – реагируют с кислородом воздуха, образуя супероксиды металлов. Поскольку катион Na + имеет промежуточный размер, натрий реагирует с кислородом с образованием соединения с промежуточной стехиометрией: пероксида натрия. Однако при определенных условиях реакции можно получить оксид, пероксид и супероксид всех пяти щелочных металлов, за исключением супероксида лития (LiO).2 Кристалл сподумена (LiAlSi 2O2 2 2 O 2 6 2 ). Этот минерал является одной из важнейших литиевых руд.2).
Обратите внимание на схемуХимия щелочных металлов в основном представляет собой ионные соединения, содержащие ионы M+.Пероксиды и супероксиды щелочных металлов являются сильными окислителями, которые часто бурно реагируют с широким спектром восстановителей, таких как древесный уголь или металлический алюминий. Например, Na используется в промышленности для отбеливания бумаги, древесной массы и тканей, таких как лен и хлопок. В подводных лодках Na и KO
Из-за малых радиусов элементы второго периода имеют сродство к электрону менее отрицательное, чем можно было бы предположить, исходя из общих периодических тенденций. Когда электрон добавляется к такому маленькому атому, повышенное электрон-электронное отталкивание имеет тенденцию к дестабилизации аниона. Кроме того, малые размеры этих элементов не позволяют им образовывать соединения, в которых они имеют более четырех ближайших соседей. Таким образом, BF
образующегося в результате дыхания, и заменяя его на O
. Оба соединения реагируют с CO2O2 в окислительно-восстановительной реакции, в которой O2O2 2- или O2 – одновременно окисляется и восстанавливается, образуя карбонат металла и O2Присутствие водяного пара, другого продукта дыхания, делает KO2 еще более эффективным для удаления CO2 поскольку образуется не карбонат калия, а бикарбонат калия:2Обратите внимание, что в этой реакции удаляется 4 моль CO2 удаляются в этой реакции, а не 2 моль, как в уравнении 21.10.2:
Литий, самый легкий щелочной металл, единственный, который реагирует с атмосферным азотом, образуя нитрид лития (Li2N). Энергии решетки снова объясняют, почему крупные щелочные металлы, такие как калий, не образуют нитридов: упаковка трех крупных катионов K+ вокруг одного относительно небольшого аниона энергетически неблагоприятна. Напротив, все щелочные металлы реагируют с более крупными элементами группы 15 – фосфором и мышьяком – с образованием фосфидов и арсенидов металлов (где Z – P или As):2Обратите внимание на схему
Из-за энергии решетки только литий образует стабильный оксид и нитрид.2Щелочные металлы реагируют со всеми элементами 14 группы, но составы и свойства продуктов существенно различаются. Например, реакция с более тяжелыми элементами 14 группы дает материалы, содержащие многоатомные анионы и трехмерные клеточные структуры, такие как K
структура которого показана здесь. Напротив, литий и натрий окисляются углеродом с образованием соединения со стехиометрией M3 (где M – Li или Na):
Из-за малых радиусов элементы второго периода имеют сродство к электрону менее отрицательное, чем можно было бы предположить, исходя из общих периодических тенденций. Когда электрон добавляется к такому маленькому атому, повышенное электрон-электронное отталкивание имеет тенденцию к дестабилизации аниона. Кроме того, малые размеры этих элементов не позволяют им образовывать соединения, в которых они имеют более четырех ближайших соседей. Таким образом, BF
4
4- иона в ионном соединении K 4Si4 4 2C2 S
4 . Ион Si 4- ион изоэлектронный и изоструктурный с молекулой P . Ион SiТакие же соединения могут быть получены при реакции металла с ацетиленом (C . Ион SiThe4Более тяжелые щелочные металлы (K, Rb и Cs) также реагируют с углеродом в форме графита. Однако вместо того, чтобы разрушать гексагональные листы атомов углерода, металлы вставляют себя между листами атомов углерода, образуя новые вещества, называемые интеркаляционными соединениями графита Соединение, которое образуется, когда более тяжелые щелочные металлы реагируют с углеродом в форме графита и вставляют себя между листами атомов углерода. (часть (a) на рисунке 21.9 “Интеркаляционные соединения графита”). Стехиометрия этих соединений включает MC4 и MC
которые имеют черный/серый цвет; MC2H2 и MC
, которые имеют синий цвет; и MC2бронзовый (часть (b) на рисунке 21.9 “Интеркаляционные соединения графита”). Удивительно высокая электропроводность этих соединений (примерно в 200 раз больше, чем у графита) объясняется чистым переносом валентного электрона щелочного металла на слои графита с образованием, например, K + C
Рисунок 21.9 Интеркаляционные соединения графита60Реакция графита со щелочными металлами, такими как K, Rb и Cs, приводит к частичному восстановлению графита и встраиванию слоев катионов щелочных металлов между n слоями атомов углерода. (a) В KC48слои ионов K+ вставляются между каждой парой слоев углерода, что дает n = 1. (b) Стехиометрия и цвет интеркалированных соединений зависят от количества слоев атомов углерода (n) между каждым слоем интеркалированных атомов металла. Эта схема иллюстрирует наиболее распространенные наблюдаемые структуры.36Реакция графита со щелочными металлами, такими как K, Rb и Cs, приводит к частичному восстановлению графита и встраиванию слоев катионов щелочных металлов между n слоями атомов углерода. (a) В KC24Все они также способны восстанавливать воду с образованием газообразного водорода:8M(s) + H 2 O(l) → 1 2 H 2 (g) + MOH(aq).8 − .
Хотя литий реагирует с водой довольно медленно, натрий реагирует довольно бурно (рис. 21.10 “Реакция натрия с водой”), а более тяжелые щелочные металлы (K, Rb и Cs) реагируют настолько бурно, что неизменно взрываются. Эта тенденция, которая не согласуется с относительными величинами восстановительных потенциалов элементов, служит еще одним примером сложного взаимодействия различных сил и явлений – в данном случае кинетики и термодинамики. Хотя движущая сила реакции наиболее велика для лития, более тяжелые металлы имеют более низкие температуры плавления. Тепло, выделяемое при реакции, заставляет их плавиться, а большая площадь поверхности жидкого металла в контакте с водой значительно ускоряет скорость реакции.
Рисунок 21.10 Реакция натрия с водой8Как и большинство элементов групп 1 и 2, натрий бурно реагирует с водой. Продуктами являются ион Na + (aq) и водородный газ, который потенциально взрывоопасен при смешивании с воздухом.
Катионы щелочных металлов встречаются в широком разнообразии ионных соединений. В общем, любая соль щелочного металла может быть получена путем реакции гидроксида щелочного металла с кислотой и последующего выпаривания воды:
Гидроксиды щелочных металлов также могут реагировать с органическими соединениями, содержащими кислый водород, с получением соли. Примером может служить получение ацетата натрия (CH
Na) путем реакции гидроксида натрия и уксусной кислоты:
Мыло представляет собой смесь натриевых и калиевых солей встречающихся в природе карбоновых кислот, таких как пальмитиновая кислота [CH
(CH
H] и стеариновой кислоты [CH
(CH
H]. Соли лития, такие как стеарат лития [CH3CO2(CH
Li], используются в качестве присадок в моторных маслах и смазках.3Комплексы щелочных металлов2)14CO2Из-за низкого положительного заряда (+1) и относительно больших ионных радиусов катионы щелочных металлов имеют лишь слабую тенденцию реагировать с простыми основаниями Льюиса с образованием металлических комплексов, подобных тем, которые обсуждались в главе 17 “Равновесия растворимости и комплексообразования”. Комплексообразование наиболее значительно для самого маленького катиона (Li+ ) и уменьшается с увеличением радиуса. В водном растворе, например, Li + образует тетраэдрический [Li(H3Комплексы щелочных металлов2)16CO2] + комплексы. Образование комплексов происходит в основном за счет электростатического взаимодействия катиона металла с полярными молекулами воды. Из-за их высокого сродства к воде безводные соли, содержащие ионы Li+ и Na+ (например, Na3Комплексы щелочных металлов2)14CO2 Тетраэдрический [Li(H
2
O) 2O)4 4 2O)6 ] + и октаэдрический [Rb(H 2SO4 2
O) Химия щелочных металлов в основном представляет собой ионные соединения, содержащие ионы M+. ] + комплексы. Ион Li + настолько мал, что может разместить вокруг себя только четыре молекулы воды, но более крупные катионы щелочных металлов имеют тенденцию связывать шесть молекул воды. . Ион SiИз-за низкого положительного заряда (+1) и относительно больших ионных радиусов катионы щелочных металлов имеют лишь слабую тенденцию к образованию комплексов с простыми основаниями Льюиса.Химия щелочных металлов в основном представляет собой ионные соединения, содержащие ионы M+. ] + комплексы. Ион Li + настолько мал, что может разместить вокруг себя только четыре молекулы воды, но более крупные катионы щелочных металлов имеют тенденцию связывать шесть молекул воды. используется в промышленности для отбеливания бумаги, древесной массы и тканей, таких как лен и хлопок. В подводных лодках Na – ), а не гидроксид:
Из-за малых радиусов элементы второго периода имеют сродство к электрону менее отрицательное, чем можно было бы предположить, исходя из общих периодических тенденций. Когда электрон добавляется к такому маленькому атому, повышенное электрон-электронное отталкивание имеет тенденцию к дестабилизации аниона. Кроме того, малые размеры этих элементов не позволяют им образовывать соединения, в которых они имеют более четырех ближайших соседей. Таким образом, BF
Сольватированные электроны. Наличие сольватированных электронов (e – , NH
) в растворах щелочных металлов в жидком аммиаке проявляется в интенсивном цвете раствора и его электропроводности.
где обозначение (am) относится к раствору аммиака, аналогично (aq), используемому для обозначения водных растворов. Без катализатора реакция, описанная в уравнении 21.20, протекает довольно медленно. Во многих случаях соль амида щелочного металла (MNH4) плохо растворима в жидком аммиаке и выпадает в осадок, но при растворении получаются очень концентрированные растворы щелочного металла. Один моль металла Cs, например, растворяется всего в 53 мл (40 г) жидкого аммиака. Чистый металл легко извлекается при испарении аммиака.
Растворы щелочных металлов в жидком аммиаке интенсивно окрашены и являются хорошими проводниками электричества из-за наличия сольватированных электронов (e – , NH
), которые не прикреплены к отдельным атомам. Сольватированный электрон слабо связан с полостью в растворителе аммиака, которая стабилизирована водородными связями. Жидкие аммиачные растворы щелочных металлов с концентрацией около 3 М или менее имеют темно-синий цвет (рис. 21.11 “Жидкие аммиачные растворы щелочных металлов”) и проводят электричество примерно в 10 раз лучше, чем водный раствор NaCl, из-за высокой подвижности сольватированных электронов. При увеличении концентрации металла выше 3 М цвет меняется на бронзовый или золотой, а проводимость увеличивается до значения, сравнимого с проводимостью чистых жидких металлов.2Рисунок 21.11 Растворы щелочных металлов в жидком аммиаке
Большинство металлов нерастворимы практически во всех растворителях, но щелочные металлы (и более тяжелые щелочноземельные металлы) легко растворяются в жидком аммиаке с образованием сольватированных катионов металла и сольватированных электронов, которые придают раствору темно-синий цвет.
Помимо сольватированных электронов, растворы щелочных металлов в жидком аммиаке содержат катион металла (M+ ), нейтральный атом металла (M), димеры металла (M3), и анион металла (M – ). Анион образуется путем присоединения электрона к однократно занятой валентной орбитали ns атома металла. Даже в отсутствие катализатора эти растворы не очень стабильны и в конечном итоге разлагаются на термодинамически предпочтительные продукты: M + NH
– и газообразный водород (уравнение 21.20). Тем не менее, сольватированный электрон является мощным восстановителем, который часто используется в синтетической химии.2Металлоорганические соединения элементов группы 1
Соединения, содержащие металл, ковалентно связанный с атомом углерода органического вида, называются металлоорганическими соединениями Соединение, содержащее металл, ковалентно связанный с атомом углерода при3), которые, безусловно, являются наиболее стабильными и известными металлоорганическими соединениями группы 1. Эти летучие твердые или жидкие вещества с низкой температурой плавления могут быть сублимированы или перегнаны при относительно низкой температуре и растворимы в неполярных растворителях. Как и органические соединения, расплавленные твердые вещества не проводят электричество в сколько-нибудь значительной степени. Литийорганические соединения имеют тенденцию к образованию олигомеров с формулой (RLi)
n
где R представляет собой органический компонент. Например, в твердом состоянии и в растворе метиллитий существует в виде тетрамера со структурой, показанной на рисунке 21.12 “Тетрамерная структура метиллития”, где каждая треугольная грань тетраэдра Li
соединена атомом углерода метильной группы. Эффективно, атом углерода каждой CH2 группы использует одну пару электронов в гибридном лепестке sp 3 для соединения трех атомов лития, что является примером двухэлектронной четырехцентровой связи. Очевидно, что такая структура, в которой каждый атом углерода, очевидно, связан с шестью другими атомами, не может быть объяснена ни одной из схем связи электрон-пара, рассмотренных в главе 8 “Ионная и ковалентная связь” и главе 9 “Молекулярная геометрия и модели ковалентной связи”. Теория молекулярных орбиталей может объяснить связь в метиллитии, но ее описание выходит за рамки данного текста.2Рисунок 21.12 Тетрамерная структура метиллития
Метиллитий не является ионным соединением; он существует в виде тетрамерного соединения (CH
Li)3 молекулы. Структура состоит из тетраэдрического расположения четырех атомов лития, причем атом углерода метильной группы расположен над серединой каждой треугольной грани тетраэдра. Таким образом, атомы углерода соединяют три атома лития, образуя четырехцентровые двухэлектронные связи. содержит SСвойства и реакционная способность металлоорганических соединений значительно отличаются от свойств и реакционной способности металлических или органических компонентов.4Натриевые и калийорганические соединения являются более ионными, чем литийорганические соединения. Они содержат дискретные ионы M + и R – и нерастворимы или лишь скупо растворимы в неполярных растворителях.3Применение щелочных металлов
Поскольку натрий остается жидким в широком диапазоне температур (97,8-883°C), он используется в качестве охлаждающей жидкости в специализированных высокотемпературных приложениях, таких как ядерные реакторы и выпускные клапаны в высокопроизводительных двигателях спортивных автомобилей. Благодаря низкой энергии ионизации цезий используется в фотосенсорах в автоматических дверях, туалетах, сигнализациях и других электронных устройствах. В этих устройствах цезий ионизируется пучком видимого света, производя тем самым небольшой электрический ток; блокировка света прерывает электрический ток и вызывает ответную реакцию.
Соединения натрия и калия производятся в огромных масштабах в промышленности. Ежегодно в число 50 крупнейших промышленных соединений входят NaOH, используемый в самых разных промышленных процессах; Na3используется в производстве стекла; K4O, используемый в фарфоровой глазури; и Na
Из-за малых радиусов элементы второго периода имеют сродство к электрону менее отрицательное, чем можно было бы предположить, исходя из общих периодических тенденций. Когда электрон добавляется к такому маленькому атому, повышенное электрон-электронное отталкивание имеет тенденцию к дестабилизации аниона. Кроме того, малые размеры этих элементов не позволяют им образовывать соединения, в которых они имеют более четырех ближайших соседей. Таким образом, BF
используемый в моющих средствах.
Некоторые другие соединения щелочных металлов также являются
Для каждого применения выберите более подходящее вещество на основе свойств и реакций щелочных металлов и их соединений. Объясните свой выбор в каждом случае.
Для реакции, требующей сильного основания в растворе тетрагидрофурана (THF), вы бы использовали LiOH или CsOH?
Для тушения пожара, вызванного горением металлического лития, вы бы использовали воду, газ CO2CO3 газ или песок (SiO2Как LiNO4 и CsNO4 хорошо растворимы в ацетоне (2-пропаноне). Какую из этих солей щелочных металлов вы бы использовали для осаждения I – из ацетонового раствора?
Дано: задача и выбранные щелочные металлы.2CO3 Задано: соответствующий металл для каждого применения
Стратегия:
Используя свойства и реакционные способности, рассмотренные в этом разделе, определите, какой щелочной металл наиболее подходит для указанного применения.
- Решение:
- И LiOH, и CsOH являются ионными соединениями, содержащими гидроксид-анион. Li + , однако, намного меньше, чем Cs + , поэтому катион Li + будет более эффективно сольватирован кислородом THF с его одинокими парами электронов. Это различие будет иметь два эффекта: (1) LiOH, вероятно, будет гораздо более растворимым, чем CsOH в неполярном растворителе, что может быть значительным преимуществом, и (2) сольватированные ионы Li + с меньшей вероятностью образуют плотные ионные пары с ионами OH – в относительно неполярном растворе, делая OH – более основным и, следовательно, более реакционноспособным. Таким образом, LiOH является лучшим выбором.2, N2Литий является сильным восстановителем, который реагирует с водой с образованием LiOH и H2)?
- газ, поэтому добавление источника водорода, такого как вода, к литиевому огню, скорее всего, приведет к взрыву. Литий также реагирует с кислородом и азотом в воздухе с образованием Li3O и Li3N, соответственно, поэтому мы не ожидаем, что азот потушит литиевый пожар. Поскольку CO
является газообразной молекулой, содержащей углерод в наивысшей доступной степени окисления (+4), добавление CO
к сильному восстановителю, такому как Li, должно привести к активной окислительно-восстановительной реакции. Таким образом, вода, N
Решение:
не подходят для тушения литиевого пожара. В отличие от этого, песок представляет собой в основном SiO
Все пять элементов группы 13 имеют валентную электронную конфигурацию ns 2 np 1, поэтому ожидается, что они образуют ионы с зарядом +3 в результате потери всех валентных электронов. Эффект инертной пары должен быть наиболее важным для самого тяжелого элемента (Tl), поэтому он, скорее всего, будет образовывать соединения в степени окисления, которая ниже на 2. Таким образом, для таллия, по прогнозам, наиболее важным будет состояние окисления +1.
- Соль с меньшим катионом имеет более высокую энергию решетки, а высокая энергия решетки обычно снижает растворимость соли (более подробную информацию об энергии решетки см. в главе 8 “Ионная и ковалентная связь”). Однако энергия сольватации катиона также важна для определения растворимости, и маленькие катионы, как правило, имеют более высокую энергию сольватации. Вспомните из главы 13 “Растворы”, что высокая энергия сольватации, как правило, увеличивает растворимость ионных веществ. Таким образом, CsI должен быть наименее растворимым из иодидов щелочных металлов, а LiI – наиболее растворимым. Следовательно, CsNO
- является лучшим выбором.2Укажите, какой из приведенных альтернативных щелочных металлов или их соединений является более подходящим для каждого случая применения.2сушильный агент для органического растворителя – Li3 или Rb2удаление следовых количеств N2 из высокоочищенного Ar2A Определите, является ли один из реактантов окислителем или восстановителем, сильной кислотой или сильным основанием. Если да, то, скорее всего, имеет место окислительно-восстановительная или кислотно-основная реакция. Определите продукты реакции.2 B Если прогнозируется протекание реакции, уравновесьте химическое уравнение.2 Решение:
- A Натрий является восстановителем, а кислород – окислителем, поэтому наиболее вероятна окислительно-восстановительная реакция. Мы ожидаем, что электрон будет передан от Na (таким образом, образуется Na + ) к O3. Теперь нам нужно определить, является ли восстановленный продукт супероксидом (O
– ), пероксид (O
- 2- ) или оксид (O 2- ). При нормальных условиях реакции продукт реакции щелочного металла с кислородом зависит от принадлежности металла. Из-за различий в энергии решетки Li образует оксид (Li2SO4O), более тяжелые металлы (K, Rb, Cs) производят супероксид (MO2SO4
- ), а Na производит пероксид (Na2 B Сбалансированное химическое уравнение: 2Na(s) + O
- (г) → Na
Pb наиболее стабилен в виде M 2+ .
A Li
O – это ионная соль, содержащая оксид-ион (O 2- ), который является полностью депротонированной формой воды и, следовательно, должен быть сильным основанием. Другой реагент, вода, является одновременно слабой кислотой и слабым основанием, поэтому можно предсказать, что произойдет кислотно-основная реакция.
B Сбалансированное химическое уравнение имеет вид Li
O(s) + H
Решение:
A Калий является восстановителем, тогда как метанол является одновременно слабой кислотой и слабым основанием (подобно воде). Слабая кислота производит H + , который может действовать как окислитель, принимая электрон с образованием 1 2 H 2 . Таким образом, эта реакция представляет собой диссоциацию кислоты, которая завершается восстановлением протонов по мере их высвобождения.
B Сбалансированное химическое уравнение выглядит следующим образом: K(s) + CH 3 OH(l) → 1 2 H 2 (g) + CH 3 OK (soln) .
Все пять элементов группы 13 имеют валентную электронную конфигурацию ns 2 np 1, поэтому ожидается, что они образуют ионы с зарядом +3 в результате потери всех валентных электронов. Эффект инертной пары должен быть наиболее важным для самого тяжелого элемента (Tl), поэтому он, скорее всего, будет образовывать соединения в степени окисления, которая ниже на 2. Таким образом, для таллия, по прогнозам, наиболее важным будет состояние окисления +1.
B Для уравнения требуется два моля лития: 2Li(s) + CH2Cl(l) → LiCl(s) + CH2Li(soln).2 A Нитрид лития и хлорид калия являются в значительной степени ионными соединениями. Нитрид-ион (N 3- ) является очень сильным основанием, поскольку он представляет собой полностью депротонированную форму аммиака, слабой кислоты. Однако для кислотно-основной реакции требуется как кислота, так и основание, а KCl не является кислотой. А как насчет окислительно-восстановительной реакции? Оба вещества содержат ионы, которые имеют валентную электронную конфигурацию с замкнутой оболочкой. Нитрид-ион может выступать в качестве восстановителя, отдавая электроны окислителю и образуя N2. Однако KCl не является окислителем, а окислительно-восстановительная реакция требует наличия как окислителя, так и восстановителя.2 B Мы заключаем, что эти два вещества не будут реагировать друг с другом.2O2).
Предскажите продукты каждой реакции и уравновесьте каждое химическое уравнение.2 Ответ: 2O2нет реакции
N(s) + 3H2O(l) → NH
(aq) + 3LiOH(aq)2Na(s) + ( CH 3 ) 2 NH (soln) → 1 2 H 2 (g) + Na [ ( CH 3 ) 2 N ] (soln)2Li(soln) + D
O(l) → C
D(l) + LiOD(soln)
Cl(soln) + 2Li → CH
Li(soln) + LiCl(soln)3Резюме3Первые выделенные щелочные металлы (Na и K) были получены путем пропускания электрического тока через расплавленные карбонаты калия и натрия. Щелочные металлы являются одними из самых мощных восстановителей; большинство из них можно выделить электролизом их расплавленных солей или, в случае рубидия и цезия, путем реакции их гидроксидных солей с восстановителем. Они также могут быть извлечены из силикатных руд с помощью многоступенчатого процесса. Литий, самый сильный восстановитель, и натрий, самый слабый, являются примерами физико-химических эффектов противоположных периодических тенденций. Щелочные металлы реагируют с галогенами (группа 17) с образованием ионных галогенидов; более тяжелые халькогены (группа 16) с образованием халькогенидов металлов; кислород образует соединения, стехиометрия которых зависит от размера атома металла. Пероксиды и супероксиды являются сильными окислителями. Единственным щелочным металлом, реагирующим с атмосферным азотом, является литий. Более тяжелые щелочные металлы реагируют с графитом, образуя графитовые интеркаляционные соединения, вещества, в которых атомы металла вставлены между листами атомов углерода. С более тяжелыми элементами 14-й группы щелочные металлы реагируют, образуя многоатомные анионы с трехмерной клетчатой структурой. Все щелочные металлы реагируют с водородом при высоких температурах, образуя соответствующие гидриды, и все восстанавливают воду с образованием газообразного водорода. Соли щелочных металлов получают путем реакции гидроксида металла с кислотой с последующим выпариванием воды. Соли Li и Na используются в качестве высушивающих агентов – соединений, поглощающих воду. Комплексообразователи, такие как краун-эфиры и криптанды, могут вмещать ионы щелочных металлов соответствующего размера. Щелочные металлы также могут реагировать с жидким аммиаком с образованием растворов, которые медленно разлагаются с выделением газообразного водорода и металлической соли амидного иона (NH
– ). Эти растворы, содержащие нестабильные сольватированные электроны, слабо связанные с полостью в растворителе, интенсивно окрашены, являются хорошими проводниками электричества и отличными восстановителями. Щелочные металлы могут реагировать с органическими соединениями, содержащими кислотный протон, с образованием солей. Они также могут образовывать металлоорганические соединения, свойства которых отличаются от свойств их металлических и органических компонентов.2Основные выводы
Щелочные металлы являются сильными восстановителями, химия которых в значительной степени относится к ионным соединениям, содержащим ион M+.
Щелочные металлы имеют лишь слабую тенденцию к образованию комплексов с простыми основаниями Льюиса.
Pb наиболее стабилен в виде M 2+ .
- Какой из элементов первой группы наименее легко реагирует с кислородом? Какой из них с наибольшей вероятностью образует гидратированную кристаллическую соль? Объясните свои ответы.
- Li3Щелочные металлы имеют значительное сродство к электрону, соответствующее присоединению электрона для получения M – аниона. Почему же тогда они обычно теряют электрон ns 1, образуя катион M +, а не приобретают электрон, образуя M – ?2Литий – гораздо более сильный восстановитель, чем натрий; цезий – почти такой же сильный, как литий, что не согласуется с ожидаемой периодической тенденцией.3Электролиз часто используется для выделения легких щелочных металлов из их расплавленных галогенидов. Почему используются галогениды, а не оксиды или карбонаты, которые легче выделить? Учитывая это, какова цель добавления хлорида кальция к галогениду щелочного металла?
- Единственный щелочной металл, который реагирует с кислородом с образованием соединения с ожидаемой стехиометрией, – это литий, который дает Li
- C6H5O. Натрий, напротив, реагирует с кислородом, давая Na2, а более тяжелые щелочные металлы образуют супероксиды. Объясните разницу в стехиометрии этих продуктов.6H5Классифицируйте водные растворы Li
- CH3CH2O, Na3CH2O, и CsO
эфф
Хотя метанол относительно нереакционноспособен, его можно превратить в синтетически более полезную форму путем реакции с LiH. Предскажите продукты реакции метанола с LiH. Опишите визуальные изменения, которые вы ожидаете увидеть во время этой реакции.2Литий реагирует с атмосферным азотом, образуя нитрид лития (Li
N). Почему другие щелочные металлы не образуют аналогичных нитридов? Объясните, почему все щелочные металлы реагируют с мышьяком с образованием соответствующих арсенидов (M
- As).
- Структура и реакционная способность
Расположите K, Cs, Sr, Ca, Ba и Li в порядке
электролиз плавленого (расплавленного) хлорида натрия
термическое разложение KClO
получение фтористого водорода из фтористого кальция и серной кислоты
окисление металлического натрия кислородом2Какие продукты образуются на аноде и катоде при электролизе
расплавленного гидрида лития?
расплавленного хлорида лития?
водного фторида натрия?2Напишите соответствующие полуреакции для каждой реакции.2O2Металлический натрий получают электролизом расплавленного NaCl. Если при электролизе расплавленной соли при силе тока 9,6 А (С/с) образуется 25,0 г газа хлора, сколько часов потребовалось для реакции? Какая масса натрия была получена?
Пероксид натрия может удалять CO2 из воздуха и заменять его кислородом в соответствии со следующим несбалансированным химическим уравнением:2Сбалансируйте химическое уравнение.2Определите каждую полуреакцию окисления и восстановления.
Предполагая полную реакцию, какое давление будет внутри герметичного контейнера объемом 1,50 л после реакции избытка пероксида натрия с диоксидом углерода, который первоначально находился под давлением 0,133 атм при температуре 37°C?
Предскажите продукты каждой химической реакции, а затем уравновесьте каждое химическое уравнение.3Предскажите продукты каждой реакции.3алкилхлорид с металлическим литием
Металл
Образцу графита массой 655 мг дали прореагировать с металлическим калием и выделили 744 мг продукта. Какова стехиометрия продукта?
- Перхлорную кислоту, которая используется в качестве реагента в ряде химических реакций, обычно нейтрализуют перед утилизацией. Когда начинающий химик случайно использовал K
- для нейтрализации перхлорной кислоты, образовалась большая масса KClO3
- ( K
- = 1,05 × 1 0-2 ) выпала из раствора. Какая масса иона калия присутствует в 1,00 л насыщенного раствора KClO
Ключевой шаг в выделении щелочных металлов
- Знакомство с реакциями, соединениями и комплексами щелочноземельных металлов.
- Как и щелочные металлы, щелочноземельные металлы настолько реакционноспособны, что никогда не встречаются в природе в элементарной форме. Поскольку они образуют ионы +2, имеющие очень отрицательные восстановительные потенциалы, для их выделения из руд требуется большое количество энергии. Четыре из шести элементов второй группы – магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba) – были впервые выделены в начале XIX века сэром Хамфри Дэви с помощью метода, аналогичного тому, который он использовал для получения первых щелочных металлов. Однако, в отличие от щелочных металлов, соединения щелочноземельных металлов были признаны уникальными на протяжении многих веков. В действительности, название щелочи происходит от арабского al-qili, что означает “пепел”, который, как известно, нейтрализует кислоты. Средневековые алхимики обнаружили, что часть золы плавится при нагревании, и эти вещества позже были идентифицированы как карбонаты натрия и калия (M
- ). Зола, которая не плавилась (но растворялась в кислоте), первоначально называемая щелочными землями, впоследствии была идентифицирована как оксиды щелочных земель (МО). В 1808 году Дэви удалось получить чистые образцы Mg, Ca, Sr и Ba путем электролиза их хлоридов или оксидов.
Бериллий (Be), самый легкий щелочноземельный металл, был впервые получен в 1828 году Фридрихом Вёлером в Германии и одновременно Антуаном Бюсси во Франции. Метод, использованный обоими учеными, заключался в восстановлении хлорида мощным “новым” восстановителем – калием:
BeCl 2 (s) + 2 K (s) → Δ Be (s) + 2 KCl (s).
Радий был открыт в 1898 году Пьером и Марией Кюри, которые переработали тонны остатков урановых рудников, чтобы получить около 120 мг почти чистого RaCl2. За его открытие Мари Кюри была удостоена Нобелевской премии по химии в 1911 году. Однако из-за низкой распространенности и высокой радиоактивности радий имеет мало применений и далее обсуждаться не будет.
- Получение щелочноземельных металлов
- Щелочноземельные металлы получают для промышленного использования путем электролитического восстановления их расплавленных хлоридов, как указано в данном уравнении для кальция:
- Хлориды металлов группы 2 получают из различных источников. Например, BeCl
получают путем реакции HCl с бериллием (BeO), который получают из полудрагоценного камня берилла [Be
(SiO
- Кристалл берилла. Берилл является драгоценным камнем и важным источником бериллия.
- Для получения элементов группы 2 можно также использовать химические восстановители. Например, магний производится в больших масштабах путем нагревания известняка, называемого доломитом (CaCO
-MgCO
) с недорогим сплавом железа и кремния при температуре 1150°C. Первоначально выделяется CO2CO3 выделяется, оставляя после себя смесь CaO и MgO; затем Mg 2+ восстанавливается:4Ранним источником магния была руда под названием магнезит (MgCOsp) из района северной Греции под названием Магнезия. Стронций был получен из стронцианита (SrCO4?
), найденного в свинцовой шахте в городе Стронтиан в Шотландии. Щелочноземельные металлы несколько легче выделить из2CO3Ранним источником магния была руда под названием магнезит (MgCOspТаблица 21.4 Избранные свойства элементов группы 22CO3Бериллий2CO3Магний
21.2 Химия водорода
Стронций
Ознакомиться с реакциями, соединениями и комплексами щелочных металлов.
- Радий
- атомный символ
атомный номер2CO3атомная масса
9.01
24.31
40.08287.62
137.33
конфигурация валентного электрона
2 s 223 s 23Al24 s 23)6].

5 s 2
6 s 237 s 23температура плавления/кипения (°C)21287/2471
650/10903842/14843777/1382
727/1897
700/-
плотность (г/см 3 ) при 25°C
1.85
| 1.74 | 1.54 | 2.64 | 3.62 | атомный радиус (пм) | энергия первой ионизации (кДж/моль) | |
|---|---|---|---|---|---|---|
| атомная масса | Be | Mg | Ca | Sr | Ba | Ra |
| 6.94 | 4 | 12 | 20 | 38 | 56 | 88 |
| 22.99 | -14 | электроотрицательность | стандартный электродный потенциал (E °, В) | -1.85 | -2.37 | 226 |
| 3 s 1 | -2.90 | -2.91 | -2.8 | продукт реакции с O | BeO | MgO |
| 97.8/883 | SrO | BaO | тип оксида | амфотерный | слабоосновный | основной |
| 0.97 | основной | продукт реакции с N | нет | продукт реакции с X | BeX | ∼5 |
| наиболее распространенное состояние окисления | 112 | 145 | 194 | 219 | 253 | — |
| ионный радиус (пм)* | 900 | 738 | 590 | 549 | 503 | — |
| сродство к электрону (кДж/моль) | +2 | +2 | +2 | +2 | +2 | +2 |
| -60 | 45 | 72 | 100 | 118 | 135 | — |
| -53 | ≥ 0 | ≥ 0 | −2 | −5 | нет | — |
| -3.04 | 1.6 | 1.3 | 1.0 | 1.0 | 0.9 | 0.9 |
| -2.71 | SrH | BaH | * Приведенные значения относятся к шестикоординированным ионам, за исключением Be 2+ , для которого указано значение для четырехкоординированного иона. | Как и в случае щелочных металлов, атомные и ионные радиусы щелочноземельных металлов плавно увеличиваются от Be к Ba, а энергии ионизации уменьшаются. Как и следовало ожидать, первая энергия ионизации щелочноземельного металла с валентной электронной конфигурацией ns 2 всегда значительно больше, чем у щелочного металла, непосредственно предшествующего ему. Однако элементы группы 2 демонстрируют некоторые аномалии. Например, плотность Ca меньше, чем у Be и Mg, двух самых легких членов группы, а Mg имеет самые низкие температуры плавления и кипения. В отличие от щелочных металлов, самый тяжелый щелочноземельный металл (Ba) является самым сильным восстановителем, а самый легкий (Be) – самым слабым. Стандартные электродные потенциалы Ca и Sr не сильно отличаются от Ba, что указывает на то, что противоположные тенденции в энергиях ионизации и гидратации имеют примерно одинаковое значение. | Одним из основных различий между элементами первой и второй групп является их электронное сродство. Со своими наполовину заполненными ns-орбиталями щелочные металлы имеют значительное сродство к дополнительному электрону. В отличие от них, щелочноземельные металлы обычно не стремятся принять дополнительный электрон, поскольку их валентные орбитали ns уже заполнены; добавленный электрон должен занять одну из вакантных орбиталей np, энергия которых намного выше. | Реакции и соединения щелочноземельных металлов |
| CsO2 | Обратите внимание на закономерность | Элементы группы 2 почти исключительно образуют ионные соединения, содержащие ионы M 2+. | Обратите внимание на схему | Из-за более высокой энергии ионизации и малого размера Be и Mg образуют металлоорганические соединения. | Все щелочноземельные металлы бурно реагируют с галогенами (группа 17) с образованием соответствующих галогенидов (MX2 | — |
| основной | . Эти соединения летучи, образуя пары, содержащие линейные молекулы X-Be-X, предсказанные моделью электронно-парного отталкивания валентной оболочки (VSEPR). (Более подробную информацию о модели VSEPR см. в главе 9 “Молекулярная геометрия и модели ковалентных связей”). Как и ожидалось для соединений, имеющих только четыре валентных электрона вокруг центрального атома, галогениды бериллия являются сильными кислотами Льюиса. Они легко реагируют с основаниями Льюиса, такими как эфиры, образуя тетраэдрические аддукты, в которых центральный бериллий окружен октетом электронов: | Твердый хлорид бериллия (BeCl | основной | основной | основной | — |
| нет2 | нет | Mg3N2 | Ca3N2 | Sr3N2 | Ba3N2 | — |
| NaX2 | Реакции щелочноземельных металлов с более тяжелыми халькогенами (Y) аналогичны реакциям щелочных металлов. Когда реактивы присутствуют в соотношении 1:1, образуются бинарные халькогениды (MY); при более низких соотношениях M:Y образуются соли, содержащие полихалькогенидные ионы (Y2 | n 2 | 2- ) образуются.2 | В обратном уравнении 21.25 оксиды Ca, Sr и Ba реагируют с CO2 | для регенерации карбоната. За исключением BeO, который имеет значительный ковалентный характер и поэтому является амфотерным, все щелочноземельные оксиды являются основными. Таким образом, они реагируют с водой с образованием гидроксидов-M(OH)2 | — |
| NaH2 | нет | и растворяются в водной кислоте. Гидроксиды более легких щелочноземельных металлов нерастворимы в воде, но их растворимость увеличивается по мере увеличения атомного номера металла. Поскольку BeO и MgO гораздо более инертны, чем другие оксиды группы 2, они используются в качестве огнеупорных материалов в областях, связанных с высокими температурами и механическими нагрузками. Например, MgO (температура плавления = 2825°C) используется для покрытия нагревательных элементов в электрических плитах.2 | Карбонаты щелочноземельных металлов также реагируют с водной кислотой, давая CO2 | и H2 | Реакция, описанная в уравнении 21.27, лежит в основе антацидов, содержащих MCO2 | — |
| который используется для нейтрализации избыточной кислоты в желудке. | ||||||
Тенденция реакционной способности щелочноземельных металлов с азотом противоположна той, которая наблюдается для щелочных металлов. Только самый легкий элемент (Be) не реагирует легко с N
с образованием нитрида (M
), хотя тонко разделенный Be будет реагировать при высоких температурах. Более высокая энергия решетки, обусловленная высокозаряженными ионами M 2+ и N 3-, по-видимому, достаточна для преодоления химической инертности N
молекула с ее связью N≡N. Аналогично, все щелочноземельные металлы реагируют с более тяжелыми элементами группы 15, образуя бинарные соединения, такие как фосфиды и арсениды с общей формулой M
Из-за малых радиусов элементы второго периода имеют сродство к электрону менее отрицательное, чем можно было бы предположить, исходя из общих периодических тенденций. Когда электрон добавляется к такому маленькому атому, повышенное электрон-электронное отталкивание имеет тенденцию к дестабилизации аниона. Кроме того, малые размеры этих элементов не позволяют им образовывать соединения, в которых они имеют более четырех ближайших соседей. Таким образом, BF
Более высокая энергия решетки приводит к тому, что щелочноземельные металлы более реакционноспособны по отношению к элементам группы 15, чем щелочные металлы.
Из-за малых радиусов элементы второго периода имеют сродство к электрону менее отрицательное, чем можно было бы предположить, исходя из общих периодических тенденций. Когда электрон добавляется к такому маленькому атому, повышенное электрон-электронное отталкивание имеет тенденцию к дестабилизации аниона. Кроме того, малые размеры этих элементов не позволяют им образовывать соединения, в которых они имеют более четырех ближайших соседей. Таким образом, BF
. Наиболее важным карбидом щелочноземельных металлов является карбид кальция (CaC
), который легко реагирует с водой с образованием ацетилена. В течение многих лет эта реакция была основным источником ацетилена для сварки и ламп на шахтерских касках. В отличие от этого, бериллий реагирует с элементарным углеродом с образованием Be2C, который формально содержит ион C 4- (хотя соединение является ковалентным). В соответствии с этой формулировкой, реакция Be2C с водой или водной кислотой приводит к образованию метана:

Бериллий не реагирует с водородом, кроме как при высоких температурах (1500°C), хотя BeHХимия щелочных металлов в основном представляет собой ионные соединения, содержащие ионы M+.). Гидриды более тяжелых щелочноземельных металлов являются ионными, но как BeH
и MgH2 имеют полимерные структуры, которые отражают значительный ковалентный характер. Все гидриды щелочноземельных металлов являются хорошими восстановителями, быстро реагируют с водой или водной кислотой с образованием газообразного водорода:2Как и щелочные металлы, более тяжелые щелочноземельные металлы достаточно электроположительны, чтобы растворяться в жидком аммиаке. Однако в этом случае на каждый атом металла образуется два сольватированных электрона, и равновесия с участием димеров металлов или анионов металлов не известны. Также, как и щелочные металлы, щелочноземельные металлы образуют широкий спектр простых ионных солей с оксоанионами, такими как карбонат, сульфат и нитрат. Нитратные соли, как правило, растворимы, но карбонаты и сульфаты более тяжелых щелочноземельных металлов совершенно нерастворимы из-за более высокой энергии решетки, обусловленной двойным зарядом катиона и аниона. Растворимость карбонатов и сульфатов быстро уменьшается вниз по группе, поскольку энергия гидратации уменьшается с увеличением размера катиона.
Обратите внимание на закономерность
Растворимость карбонатов и сульфатов щелочноземельных металлов уменьшается вниз по группе, потому что энергия гидратации уменьшается. содержит SИз-за большего положительного заряда (+2) и меньшего ионного радиуса щелочноземельные металлы имеют гораздо большую склонность к образованию комплексов с основаниями Льюиса, чем щелочные металлы. Эта тенденция наиболее важна для самого легкого катиона (Be 2+ ) и быстро уменьшается с увеличением радиуса иона металла.
Обратите внимание на закономерность2Щелочноземельные металлы имеют значительно большую склонность к образованию комплексов с основаниями Льюиса, чем щелочные металлы.2:
В химии Be 2+ доминирует его поведение как кислоты Льюиса, образующей комплексы2] 2- . Следовательно, оксид бериллия является амфотерным. Бериллий также образует очень стабильный тетраэдрический фторидный комплекс: [BeF
] 2- . Напомним, что галогениды бериллия ведут себя как кислоты Льюиса, образуя аддукты с основаниями Льюиса (уравнение 21.24).
Более тяжелые щелочноземельные металлы также образуют комплексы, но обычно с координационным числом 6 или выше. Комплексообразование наиболее важно для более мелких катионов (Mg 2+ и Ca 2+ ). Так, водные растворы Mg 2+ содержат октаэдрический [Mg(H2] 2+ ион. Как и щелочные металлы, щелочноземельные металлы образуют комплексы с нейтральными циклическими лигандами, такими как краун-эфиры и криптанды, рассмотренные в разделе 21.3 “Щелочные металлы (группа 1)”.2O:
Металлоорганические соединения, содержащие элементы группы 23Как и щелочные металлы, самые легкие щелочноземельные металлы (Be и Mg) образуют наибольшее количество ковалентных связей с углеродом и формируют наиболее стабильные металлоорганические соединения. Металлоорганические соединения магния с формулой RMgX, где R – алкильная или арильная группа, а X – галоген, принято называть реактивами Гриньяра, в честь Виктора Гриньяра (1871-1935), французского химика, который их открыл. (Более подробную информацию о реактивах Гриньяра см. в главе 24 “Органические соединения”, раздел 24.5 “Общие классы органических соединений”). Реактивы Гриньяра могут быть использованы для синтеза различных органических соединений, таких как спирты, альдегиды, кетоны, карбоновые кислоты, сложные эфиры, тиолы и амины.
Применение щелочноземельных металлов2Элементарный магний – единственный щелочноземельный металл, который производится в больших масштабах (около 5 × 10 5 тн в год). Его низкая плотность (1,74 г/см 3 по сравнению с 7,87 г/см 3 для железа и 2,70 г/см 3 для алюминия) делает его важным компонентом легких металлических сплавов, используемых в каркасах самолетов и деталях авиационных и автомобильных двигателей (рис. 21.13 “Магниевые сплавы легки и устойчивы к коррозии”). Большая часть коммерческого алюминия содержит около 5% магния для улучшения коррозионной стойкости и механических свойств. Элементарный магний также служит недорогим и мощным восстановителем для производства ряда металлов, включая титан, цирконий, уран и даже бериллий, как показано в следующем уравнении:3N2Рисунок 21.13 Магниевые сплавы легки и устойчивы к коррозии2Поскольку магний примерно в пять раз легче стали и на 50% легче алюминия, он долгое время считался “материалом будущего”, как показано на этом концептуальном спортивном автомобиле Buick LeSabre 1950 года, сделанном почти полностью из магниевых и алюминиевых сплавов. Современные алюминиевые сплавы обычно содержат около 5% магния для улучшения их коррозионной стойкости и механических свойств.3Z2.
Из-за малых радиусов элементы второго периода имеют сродство к электрону менее отрицательное, чем можно было бы предположить, исходя из общих периодических тенденций. Когда электрон добавляется к такому маленькому атому, повышенное электрон-электронное отталкивание имеет тенденцию к дестабилизации аниона. Кроме того, малые размеры этих элементов не позволяют им образовывать соединения, в которых они имеют более четырех ближайших соседей. Таким образом, BF
Ежегодно используются миллионы тонн соединений кальция. Как обсуждалось в предыдущих главах, CaCl
используется в качестве “дорожной соли” для снижения температуры замерзания воды на дорогах при низких температурах. Кроме того, CaCO2 является основным компонентом цемента и ингредиентом многих коммерческих антацидов. “Известь негашеная (CaO), получаемая путем нагревания CaCO2 (уравнение 21.25), используется в сталелитейной промышленности для удаления оксидных примесей, изготовления многих видов стекла и нейтрализации кислой почвы. Другие применения соединений группы 2, описанные в предыдущих главах, включают медицинское использование BaSO2 в “бариевых молочных коктейлях” для выявления проблем пищеварения с помощью рентгеновских лучей и использование различных щелочноземельных соединений для получения ярких цветов, наблюдаемых в фейерверках.2Пример 4
Для каждого применения выберите наиболее подходящее вещество, основываясь на свойствах и реакционной способности щелочноземельных металлов и их соединений. Объясните свой выбор в каждом случае. Используйте любые таблицы, необходимые для принятия решения, например, K 2 (Таблица 17.1 “Продукты растворимости для отдельных ионных веществ при 25°C”), энергии решетки (Таблица 8.1 “Репрезентативные расчетные энергии решетки”) и энергии зазора (Глава 12 “Твердые тела”, Раздел 12.6 “Связь в металлах и полупроводниках”).2Для нейтрализации избыточной желудочной кислоты, вызывающей несварение желудка, вы бы использовали BeCO2, CaCO2или BaCO
Для удаления CO
Из-за малых радиусов элементы второго периода имеют сродство к электрону менее отрицательное, чем можно было бы предположить, исходя из общих периодических тенденций. Когда электрон добавляется к такому маленькому атому, повышенное электрон-электронное отталкивание имеет тенденцию к дестабилизации аниона. Кроме того, малые размеры этих элементов не позволяют им образовывать соединения, в которых они имеют более четырех ближайших соседей. Таким образом, BF
В качестве компонента сплава в электроде автомобильной свечи зажигания вы бы использовали Be, Ca или Ba?
Дано: применение и выбранные щелочноземельные металлы.
Задано: наиболее подходящее вещество для каждого применения
Из-за малых радиусов элементы второго периода имеют сродство к электрону менее отрицательное, чем можно было бы предположить, исходя из общих периодических тенденций. Когда электрон добавляется к такому маленькому атому, повышенное электрон-электронное отталкивание имеет тенденцию к дестабилизации аниона. Кроме того, малые размеры этих элементов не позволяют им образовывать соединения, в которых они имеют более четырех ближайших соседей. Таким образом, BF
На основании обсуждения в этом разделе и любой соответствующей информации в других разделах этой книги определите, какое вещество наиболее подходит для указанного применения.
Решение: 2O)4Все карбонаты щелочноземельных металлов нейтрализуют кислый раствор по уравнению 21.27. Однако, поскольку бериллий и его соли токсичны, BeCO
нельзя использовать в качестве антацида. Из оставшихся вариантов CaCO4 несколько более растворим, чем BaCO4 (в соответствии со значениями K
в таблице 17.1 “Продукты растворимости для отдельных ионных веществ при 25°C”), что позволяет предположить, что он будет действовать быстрее. Более того, формульная масса CaCO2O)6 составляет 100,1 аму, в то время как масса формулы BaCO
почти в два раза больше. Поэтому для нейтрализации данного количества кислоты потребуется вдвое большая масса BaCO
по сравнению с CaCO
. Кроме того, реакция BaCO
с кислотой приводит к образованию раствора, содержащего ионы Ba 2+ , которые являются токсичными. (Ba 2+ является стимулятором, который может вызвать фибрилляцию желудочков сердца.) Наконец, CaCO
производится в огромных масштабах, поэтому CaCO
скорее всего, будет стоить значительно дешевле, чем любое соединение бария. Следовательно, CaCO
является лучшим выбором для антацида.
Для этого используется реакция CO2 со щелочноземельным оксидом с образованием карбоната, что является обратной реакцией термического разложения, в которой MCO3 разлагается на CO3 и оксид металла MO (уравнение 21.25). Благодаря4при 1360°C). Если карбонат с наименьшим щелочноземельным металлом разлагается легче всего, мы ожидаем, что обратная реакция (образование карбоната) будет происходить легче всего с наибольшим катионом металла (Ba 2+ ). Следовательно, BaO – лучший выбор.
Сплав в электроде свечи зажигания должен высвобождать электроны и способствовать их потоку через зазор между электродами при высоких температурах. (Подробнее о твердых электролитах см. главу 12 “Твердые тела”, раздел 12.5 “Взаимосвязь между связью и свойствами твердых тел”). Из трех перечисленных металлов Ba имеет самую низкую энергию ионизации и, следовательно, легче всего отдает электроны. Нагревание сплава, содержащего барий, до высоких температур приведет к некоторой ионизации, обеспечивая начальный этап формирования искры.
Какой из указанных щелочноземельных металлов или их соединений наиболее подходит для каждого применения?spсушильный агент для удаления воды из атмосферы-CaCl
- , MgSO3или BaF3удаление отложений накипи (в основном CaCO3?
- ) в водопроводных трубах-HCl(aq) или H2(aq)
- удаление следов N
из очищенного аргонового газа – Be, Ca или Ba
Ответ:
Решение:
Предскажите продукты каждой реакции, а затем уравновесьте каждое химическое уравнение.
Все пять элементов группы 13 имеют валентную электронную конфигурацию ns 2 np 1, поэтому ожидается, что они образуют ионы с зарядом +3 в результате потери всех валентных электронов. Эффект инертной пары должен быть наиболее важным для самого тяжелого элемента (Tl), поэтому он, скорее всего, будет образовывать соединения в степени окисления, которая ниже на 2. Таким образом, для таллия, по прогнозам, наиболее важным будет состояние окисления +1.
- MgO(s) + избыток OH – (aq) →3CaH 2 (s) + TiO 2 (s) → Δ3 Дано: реактивы3 Задано: продукты и сбалансированное химическое уравнениеsp Стратегия: 3Следуйте процедуре, описанной в примере 3, чтобы предсказать продукты каждой реакции, а затем сбалансируйте каждое химическое уравнение.3 Решение: 3 Газообразная HCl является кислотой, а CaO – основным оксидом, содержащим ион O 2-. Таким образом, это кислотно-основная реакция, в результате которой образуется CaCl3 и H3 B Сбалансированное химическое уравнение: CaO(s) + 2HCl(g) → CaCl3(aq) + H3O(l).3 A Оксид магния является основным оксидом, поэтому он может либо реагировать с водой, образуя основной раствор, либо растворяться в кислом растворе. Гидроксид-ион также является основанием. Поскольку у нас есть два основания, но нет кислоты, кислотно-основная реакция невозможна. Окислительно-восстановительная реакция маловероятна, потому что MgO не является ни хорошим окислителем, ни хорошим восстановителем.
- B Мы заключаем, что реакция не происходит.2 A Поскольку CaH3 содержит гидрид-ион (H – ), он является хорошим восстановителем. Он также является сильным основанием, потому что ионы H – могут реагировать с ионами H + с образованием H2. Оксид титана (TiO3) – это оксид металла, который содержит металл в высшей степени окисления (+4 для металла группы 4); он может действовать как окислитель, принимая электроны. Поэтому мы предсказываем, что произойдет окислительно-восстановительная реакция, в которой H – окисляется, а Ti 4+ восстанавливается. Наиболее вероятным продуктом восстановления является металлический титан, но что является продуктом окисления? В продуктах должен присутствовать кислород, а как CaO, так и H3O являются стабильными соединениями. Степень окисления водорода +1 в H
- O является признаком того, что произошло окисление (2H – → 2H + + 4e – ).
B Сбалансированное химическое уравнение: CaH 2 (s) + TiO 2 (s) → Δ Ti(s) + CaO(s) + H 2 O(l) . Мы также можем записать продукты как Ti(s) + Ca(OH)
- (s).2Предскажите продукты каждой реакции, а затем уравновесьте каждое химическое уравнение.4Чистые образцы большинства щелочноземельных металлов можно получить электролизом хлоридов или оксидов. Бериллий был впервые получен восстановлением его хлорида; хлорид радия, который является радиоактивным, был получен в результате ряда реакций и разделения. В отличие от щелочных металлов, щелочноземельные металлы обычно имеют малое сродство к добавочному электрону или вообще не имеют его. Все щелочноземельные металлы реагируют с галогенами с образованием соответствующих галогенидов, с кислородом с образованием оксида (кроме бария, который образует пероксид) и с более тяжелыми халькогенами с образованием халькогенидов или полихалькогенидных ионов. Все оксиды, за исключением BeO, реагируют с CO2
- с образованием карбонатов, которые, в свою очередь, реагируют с кислотой с образованием CO3 и H2SO4O. За исключением Be, все щелочноземельные металлы реагируют с N
- с образованием нитридов, и все реагируют с углеродом и водородом с образованием карбидов и гидридов. Щелочноземельные металлы растворяются в жидком аммиаке, образуя растворы, содержащие два сольватированных электрона на атом металла. Щелочноземельные металлы имеют большую склонность к образованию комплексов с краун-эфирами, криптандами и другими основаниями Льюиса, чем щелочные металлы. Наиболее важными металлоорганическими соединениями щелочноземельных металлов являются реактивы Гриньяра (RMgX), которые используются для синтеза органических соединений.2Ключевой момент
Pb наиболее стабилен в виде M 2+ .
Концептуальные проблемы
O – это ионная соль, содержащая оксид-ион (O 2- ), который является полностью депротонированной формой воды и, следовательно, должен быть сильным основанием. Другой реагент, вода, является одновременно слабой кислотой и слабым основанием, поэтому можно предсказать, что произойдет кислотно-основная реакция.
- Расположите Na, Ba, Cs и Li в порядке возрастания Z
- eff
- Ожидаете ли вы, что температура плавления NaCl будет больше, равна или меньше температуры плавления MgCl?
B Сбалансированное химическое уравнение имеет вид Li
O(s) + H
Решение:
Почему в реакциях щелочноземельных металлов с азотом наблюдается тенденция, обратная той, которая наблюдается для щелочных металлов?
Все пять элементов группы 13 имеют валентную электронную конфигурацию ns 2 np 1, поэтому ожидается, что они образуют ионы с зарядом +3 в результате потери всех валентных электронов. Эффект инертной пары должен быть наиболее важным для самого тяжелого элемента (Tl), поэтому он, скорее всего, будет образовывать соединения в степени окисления, которая ниже на 2. Таким образом, для таллия, по прогнозам, наиболее важным будет состояние окисления +1.
Используя аргументы, основанные на размере иона, заряде и химической реактивности, объясните, почему оксид бериллия является амфотерным. Какой элемент, по вашему мнению, наиболее похож на бериллий по своей реакционной способности? Почему?2] 2+ ион. Как и щелочные металлы, щелочноземельные металлы образуют комплексы с нейтральными циклическими лигандами, такими как краун-эфиры и криптанды, рассмотренные в разделе 21.3 “Щелочные металлы (группа 1)”.2O.
Оксид бериллия является амфотерным, оксид магния – слабоосновным, а оксид кальция – очень основным. Объясните, как эта тенденция связана с ионным характером оксидов.2Ожидаете ли вы, что Δ H f ° для CaH2 будет больше, столько же или меньше, чем у BaH
? Почему или почему нет?
Какой из s-блочных элементов вы бы выбрали для проведения химического восстановления в небольших масштабах? При выборе учитывайте стоимость, реакционную способность и стабильность. Как изменится ваш выбор, если восстановление будет проводиться в промышленных масштабах?
Структура и реакционная способность2Йодид бериллия бурно реагирует с водой с образованием HI. Напишите сбалансированное химическое уравнение для этой реакции и объясните, почему она протекает бурно.2Предскажите продукты каждой реакции, а затем сбалансируйте каждое химическое уравнение.2Mg(OH)2(aq) + (NH2(aq) →
карбонат кальция и серная кислота →2нет реакции
O – это ионная соль, содержащая оксид-ион (O 2- ), который является полностью депротонированной формой воды и, следовательно, должен быть сильным основанием. Другой реагент, вода, является одновременно слабой кислотой и слабым основанием, поэтому можно предсказать, что произойдет кислотно-основная реакция.
- (aq) →
- термическое разложение SrCO2Предскажите продукты каждой реакции, а затем сбалансируйте каждое химическое уравнение.2SO4Укажите, будет ли реагировать каждая пара веществ, и, если да, напишите сбалансированное химическое уравнение реакции.
- алкилхлорид и металлический магний2металлический стронций и азот
Pb наиболее стабилен в виде M 2+ .
- бериллий и азот
- термическое разложение SrCO2Предскажите продукты каждой реакции, а затем сбалансируйте каждое химическое уравнение.2SO4 составляе т-463 кДж/моль, а Δ H ° для N(g) + 3e – → N 3- составляет +1736 кДж.) Как энергия решетки Mg4 по сравнению с MgCl
- и MgO? (Значения энтальпии образования см. в главе 25 “Приложение A: Стандартные термодинамические величины для химических веществ при 25°C”).2Произведения растворимости карбонатных солей магния, кальция и стронция составляют 6,82 × 1 0-6 , 3,36 × 1 0-9 , и 5,60 × 1 0-10 , соответственно. Сколько миллиграммов каждого соединения будет содержаться в 200,0 мл насыщенного раствора каждого из них? Как растворимость будет зависеть от pH раствора? Почему?4Продукты растворимости BaSO
эфф
составляют 1,08 × 1 0-10 и 4,93 × 1 0-5 соответственно. Чем объясняется такое различие? Когда 500,0 мл раствора, содержащего 1,00 М Ba(NO2 и 3,00 М Ca(NO2] 2+ ион. Как и щелочные металлы, щелочноземельные металлы образуют комплексы с нейтральными циклическими лигандами, такими как краун-эфиры и криптанды, рассмотренные в разделе 21.3 “Щелочные металлы (группа 1)”.2образуется осадок. Какова природа этого осадка? Сколько его образуется до выпадения второй соли?2Электролитическое восстановление используется для получения металлического магния из MgCl
Концептуальные проблемы
- Сколько килограммов MgCl
Расположите K, Cs, Sr, Ca, Ba и Li в порядке
Сколько литров хлорного газа выделится при стандартной температуре и давлении?
Сколько часов потребуется для обработки металлического магния, если общий ток составляет 1,00 × 10 4 А?Диагональная линия на рисунке 21.1 “Сводка периодических тенденций в атомных свойствах” отделяет металлы (слева от линии) от неметаллов (справа от линии). Поскольку металлы имеют относительно низкую электроотрицательность, они склонны терять электроны в химических реакциях с элементами, имеющими относительно высокую электроотрицательность, образуя соединения, в которых они имеют положительные степени окисления. Напротив, неметаллы имеют высокую электроотрицательность, и поэтому они склонны приобретать электроны в химических реакциях, образуя соединения, в которых они имеют отрицательную степень окисления. Полуметаллы лежат вдоль диагональной линии, разделяющей металлы и неметаллы. Неудивительно, что они проявляют свойства и реакционную способность, промежуточные между свойствами металлов и неметаллов. Поскольку элементы групп 13, 14 и 15 проходят по диагональной линии, разделяющей металлы и неметаллы, их химический состав более сложен, чем можно было бы предположить, основываясь только на их валентных электронных конфигурациях..
Какая масса гидрида магния прореагирует с водой с образованием 1,51 л газообразного водорода при стандартной температуре и давлении?2Ответы
Ион Ba 2+ больше и имеет меньшую энергию гидратации, чем ион Ca 2+. Осадок представляет собой BaSO
; 117 г BaSO
21.5 Элементы s-блока в биологии
Цель обучения
Ознакомиться с ролью элементов s-блока в биологии.
Элементы s-блока играют важную роль в биологических системах. Ковалентные гидриды, например, являются строительными блоками органических соединений, а другие соединения и ионы, содержащие элементы s-блока, содержатся в тканях и клеточных жидкостях. В этом разделе мы опишем некоторые способы
Существует три основных класса гидридов – ковалентные, ионные и металлические, но только ковалентные гидриды встречаются в живых клетках и имеют биохимическое значение. Как вы узнали в главе 7 “Периодическая таблица и периодические ряды”, углерод и водород имеют сходную электроотрицательность, а связи C-H в органических молекулах прочны и в основном неполярны. В расщеплении или образовании этих связей участвует мало кислотно-основной химии. Напротив, поскольку водород менее электроотрицателен, чем кислород и азот (обозначаются символом Z), связь H-Z в гидридах этих элементов поляризована (H δ+ -Z δ- ). Следовательно, атомы водорода в этих связях H-Z являются относительно кислыми. Кроме того, связи S-H относительно слабы из-за плохого перекрывания s-орбиталей, поэтому они легко расщепляются с образованием протона. Гидриды, в которых H связан с атомами O, N или S, представляют собой полярные, гидрофильные молекулы, образующие водородные связи. Они также подвергаются кислотно-основным реакциям путем переноса протона.
Обратите внимание на схему2Ковалентные гидриды, в которых H связан с атомами O, N или S, являются полярными и гидрофильными, образуют водородные связи и переносят протон в кислотно-основных реакциях.2Водородные связи имеют решающее значение в биохимии, в частности потому, что они помогают удерживать белки в их биологически активных складчатых структурах. Водородные связи также соединяют две переплетающиеся нити ДНК (дезоксирибонуклеиновой кислоты) – вещества, содержащего генетический код всех организмов. (Более подробную информацию о ДНК можно найти в главе 24 “Органические соединения”, раздел 24.6 “Молекулы жизни”). Поскольку водородные связи легче разорвать, чем ковалентные связи, образующие отдельные нити ДНК, две переплетенные нити можно разделить, чтобы получить неповрежденные отдельные нити, что необходимо для дублирования генетической информации.
В дополнение к важности водородных связей в биохимических молекулах, обширная сеть водородных связей в воде является одним из ключей к существованию жизни на нашей планете. Исходя из молекулярной массы, вода должна быть газом при комнатной температуре (20°C), но сильные межмолекулярные взаимодействия в жидкой воде значительно повышают ее температуру кипения. Водородная связь также создает относительно открытое расположение молекул во льду, из-за чего лед имеет меньшую плотность, чем вода. Поскольку лед плавает на поверхности воды, он создает изолирующий слой, который позволяет водным организмам выживать в холодные зимние месяцы.
Металл
Обратите внимание на закономерность
O – это ионная соль, содержащая оксид-ион (O 2- ), который является полностью депротонированной формой воды и, следовательно, должен быть сильным основанием. Другой реагент, вода, является одновременно слабой кислотой и слабым основанием, поэтому можно предсказать, что произойдет кислотно-основная реакция.
- Макроминералы2Члены группы 1 и группы 2, присутствующие в организмах в наибольших количествах, – это натрий, калий, магний и кальций, все из которых образуют одноатомные катионы с зарядом +1 (группа 1, M + ) или +2 (группа 2, M 2+ ). Биологически эти элементы можно классифицировать как макроминералы (Таблица 1.6 “Примерный элементный состав типичного человека весом 70 кг”).4)3PO4Укажите, будет ли реагировать каждая пара веществ, и, если да, напишите сбалансированное химическое уравнение реакции.
- (PO
- OH] является основным компонентом костей, карбонат кальция (CaCO2Предскажите продукты каждой реакции, а затем сбалансируйте каждое химическое уравнение.3PO4Укажите, будет ли реагировать каждая пара веществ, и, если да, напишите сбалансированное химическое уравнение реакции.
- ) содержится во многих растениях. Поскольку кальций и стронций имеют схожие размеры и соотношение заряда к радиусу, небольшие количества стронция всегда присутствуют в костях и других структурных материалах, содержащих кальций. Обычно это не является проблемой, поскольку ионы Sr 2+ занимают места, которые в противном случае были бы заняты ионами Ca 2+. Однако, когда следовые количества радиоактивного 90 Sr выбрасываются в атмосферу в результате испытаний ядерного оружия или ядерной аварии, радиоактивный стронций в конечном итоге достигает земли, где он поглощается растениями, которые потребляются молочным скотом. Затем изотоп концентрируется в коровьем молоке вместе с кальцием. Поскольку радиоактивный стронций соосаждается с кальцием в гидроксиапатите, окружающем костный мозг (где вырабатываются белые кровяные клетки), у детей, которые обычно потребляют больше коровьего молока, чем взрослые, значительно повышается риск развития лейкемии – вида рака, характеризующегося чрезмерным производством белых кровяных клеток.3
O – это ионная соль, содержащая оксид-ион (O 2- ), который является полностью депротонированной формой воды и, следовательно, должен быть сильным основанием. Другой реагент, вода, является одновременно слабой кислотой и слабым основанием, поэтому можно предсказать, что произойдет кислотно-основная реакция.
Ионы Na + , K + , Mg 2+ , и Ca 2+ являются важными компонентами внутриклеточных и внеклеточных жидкостей. И Na +, и Ca 2+ содержатся в основном во внеклеточных жидкостях, таких как плазма крови, в то время как K + и Mg 2+ содержатся в основном во внутриклеточных жидкостях. Для создания и поддержания этих градиентов концентрации и предотвращения достижения системой равновесия требуются значительные затраты энергии. Таким образом, энергия необходима для переноса каждого иона через клеточную мембрану в сторону с более высокой концентрацией. Биологические машины, которые отвечают за селективный транспорт этих ионов металлов, представляют собой сложные комплексы белков, называемые ионными насосами Сложный комплекс белков, которые селективно переносят ионы через клеточные мембраны благодаря высокому сродству к ионам определенного заряда и радиуса. . Ионные насосы распознают и различают ионы металлов точно так же, как краун-эфиры и криптанды, обладая высоким сродством к ионам с определенным зарядом и радиусом.
- Дефекты ионных насосов или механизмов их контроля могут привести к серьезным проблемам со здоровьем. Например, муковисцидоз, самое распространенное наследственное заболевание в США, вызван дефектом в системе транспорта (в данном случае хлорид-ионов). Аналогичным образом, во многих случаях гипертония, или высокое кровяное давление, считается следствием дефекта поглощения и/или выведения Na+. Если из рациона поглощается слишком много Na + (или выделяется слишком мало), вода диффундирует из тканей в кровь, разбавляя раствор, тем самым снижая осмотическое давление в кровеносной системе. Увеличение объема крови повышает кровяное давление, в результате чего может произойти разрыв артерий, называемых аневризмами, часто в головном мозге. Поскольку высокое кровяное давление вызывает и другие медицинские проблемы, оно является одним из наиболее важных биомедицинских нарушений в современном обществе.
- Пациентам, страдающим от гипертонии, часто назначают диеты с низким содержанием натрия, в которых используются заменители NaCl, например, KCl. Хотя KCl и NaCl придают продуктам схожие вкусовые качества, K+ плохо усваивается высокоспецифичной системой Na+ – поглощения. Однако такой подход к борьбе с гипертонией является спорным, поскольку прямую корреляцию между содержанием Na+ в рационе и артериальным давлением трудно продемонстрировать в общей популяции. Более того, последние наблюдения показывают, что высокое кровяное давление может более тесно коррелировать с недостаточным потреблением кальция в рационе, чем с чрезмерным содержанием натрия. Этот вывод важен, поскольку типичная “низконатриевая” диета также содержит мало хороших источников кальция, таких как молочные продукты.
- Некоторые из наиболее важных биологических функций металлов группы 1 и группы 2 обусловлены небольшими изменениями в клеточных концентрациях иона металла. Передача нервных импульсов, например, сопровождается увеличением потока ионов Na+ в нервную клетку. Аналогично, связывание различных гормонов со специфическими рецепторами на поверхности клетки приводит к быстрому притоку Ca 2+
- Внутри клеток K + и Mg 2+ часто активируют определенные ферменты, связываясь со специфическими, отрицательно заряженными участками в структуре фермента. Хлорофилл, зеленый пигмент, используемый всеми растениями для поглощения света и запуска процесса фотосинтеза, содержит магний. В процессе фотосинтеза CO
восстанавливается с образованием сахаров, таких как глюкоза. Структура центральной части молекулы хлорофилла напоминает краун-эфир (часть (a) на рисунке 13.7 “Краун-эфиры и криптанды”) с четырьмя пятичленными азотсодержащими кольцами, соединенными вместе с образованием большого кольца, которое обеспечивает “отверстие” соответствующего размера для плотного связывания Mg 2+ .3N2 Структура центрального ядра хлорофилла, магниевого комплекса, присутствующего во всех фотосинтетических тканях. Обратите внимание на сходство с комплексами краун-эфира, обсуждаемыми в главе 13 “Растворы”.3N2Ионофоры3N2Поскольку здоровье клеток зависит от поддержания надлежащего уровня катионов во внутриклеточных жидкостях, любое изменение, влияющее на нормальный поток ионов металлов через клеточные мембраны, может привести к гибели организма. Молекулы, облегчающие перенос ионов металлов через мембраны, обычно называют ионофорами Молекула, облегчающая перенос ионов металлов через мембраны. (ион плюс фора от греческого phorein, что означает “переносить”). Многие ионофоры являются мощными антибиотиками, которые могут убивать или подавлять рост бактерий. Примером может служить валиномицин – циклическая молекула с центральной полостью, выстланной атомами кислорода (часть (a) на рисунке 21.14 “Валиномицин – антибиотик, функционирующий как ионофор”), которая похожа на полость краун-эфира (часть (a) на рисунке 13.7 “Краун-эфиры и криптанды”). Как и краун-эфир, валиномицин обладает высокой избирательностью: его сродство к K+ примерно в 1000 раз больше, чем к Na+ . Увеличивая поток ионов K + в клетки, валиномицин нарушает нормальный градиент K + через клеточную мембрану, тем самым убивая клетку (часть (b) на рисунке 21.14 “Валиномицин – антибиотик, который функционирует как ионофор”).2Рисунок 21.14 Валиномицин – антибиотик, который функционирует как ионофор
(a) Эта модель структуры комплекса K+ – валиномицин, определенная с помощью рентгеновской дифракции, показывает, как молекула валиномицина оборачивается вокруг иона K+, защищая его от окружающей среды, что напоминает комплекс краун-эфира. (Более подробную информацию о краун-эфирах см. в главе 13 “Растворы”, раздел 13.2 “Растворимость и молекулярная структура”). (b) Валиномицин убивает бактерии, облегчая перенос ионов K+ через клеточную мембрану, тем самым нарушая нормальное распределение ионов в бактерии. На поверхности мембраны валиномицин связывает ион K+. Поскольку гидрофобная внешняя часть молекулы валиномицина образует “пончик”, который защищает положительный заряд иона металла, комплекс K+ – валиномицин обладает высокой растворимостью в неполярной внутренней части мембраны. После того, как комплекс K+ -валиномицин диффундирует через мембрану во внутреннюю часть мембраны, он может диффундировать во внутреннюю часть мембраны.
Обычным способом изучения функции иона металла в биологии является замена встречающегося в природе металла на тот, реакционную способность которого можно проследить спектроскопическими методами. Замещающий ион металла должен связываться с тем же местом, что и природный ион, и иметь такое же (или большее) сродство к этому месту, о чем свидетельствует плотность заряда. Расположите следующие ионы в порядке возрастания эффективности замены Ca 2+ , ионный радиус которого составляет 100 пм (в скобках указаны ионные радиусы): Na + (102 пм), Eu 2+ (117 пм), Sr 2+ (118 пм), F – (133 пм), Pb 2+ (119 пм) и La 3+ (103 пм). Объясните свои рассуждения.4 Дано: ионы и ионные радиусы4 Задано: пригодность в качестве замены для Ca 2+3)2 Стратегия: 3)2Используя периодические тенденции, расположите ионы от наименее эффективного к наиболее эффективному в качестве замены Ca 2+ .2SO4 Решение:
Наиболее важными свойствами при определении сродства биологической молекулы к иону металла являются размер и отношение заряда к радиусу иона металла. Из перечисленных возможных замен Ca 2+ ион F – имеет противоположный заряд, поэтому он не должен иметь сродства к месту связывания Ca 2+. Na + имеет приблизительно подходящий размер, но с зарядом +1 он будет связываться гораздо слабее, чем Ca 2+ . Хотя Eu 2+ , Sr 2+ , и Pb 2+ немного больше, чем Ca 2+ , они, вероятно, достаточно похожи по размеру и заряду для связывания. Исходя из ионного радиуса, Eu 2+ должен связываться наиболее плотно из всех трех. La 3+ почти такого же размера, как Ca 2+, и имеет более высокий заряд. Имея более высокое отношение заряда к радиусу и схожий размер, La 3+ должен плотно связываться с участком Ca 2+ и быть наиболее эффективной заменой для Ca 2+ . Порядок таков: F – 2Ионный радиус K+ составляет 138 пм. Расположите следующие ионы в порядке возрастания сродства к K+ -связывающему сайту фермента (в скобках указаны ионные радиусы): Na + (102 пм), Rb + (152 пм), Ba 2+ (135 пм), Cl – (181 пм) и Tl + (150 пм).
- Резюме2Ковалентные гидриды, в которых водород связан с кислородом, азотом или серой, представляют собой полярные, гидрофильные молекулы, образующие водородные связи и участвующие в кислотно-основных реакциях. Взаимодействие водородных связей имеет решающее значение для стабилизации структуры белков и ДНК и позволяет дублировать генетическую информацию. Взаимодействие водородных связей в воде и льду также позволяет существовать жизни на нашей планете. Металлы первой и второй групп, присутствующие в организмах, являются макроминералами, которые являются важными компонентами внутриклеточных и внеклеточных жидкостей. Небольшие изменения в клеточной концентрации иона металла могут оказывать значительное влияние на биологические функции. Ионы металлов избирательно переносятся через клеточные мембраны с помощью ионных насосов, которые связывают ионы в зависимости от их заряда и радиуса. Ионофоры, многие из которых являются мощными антибиотиками, облегчают перенос ионов металлов через мембраны.
- Ключевой момент
- Среди многочисленных функций, которые они играют в биологии, элементы s-блока позволяют дублировать генетическую информацию и являются важными компонентами внутриклеточных и внеклеточных жидкостей.
Концептуальные задачи
Объясните термохимические свойства воды с точки зрения взаимодействия межмолекулярных связей. Как это влияет на глобальный климат?
Величина сродства к электрону увеличивается слева направо в периоде из-за увеличения Z
Многие белки разрушаются и становятся нефункциональными при нагревании выше определенной температуры, даже если отдельные молекулы белка не претерпевают явных химических изменений. Предложите объяснение этому наблюдению.4В Лос-Анджелесе круглый год стоит умеренная погода со средней температурой от 57 до 70°F. Напротив, в Палм-Спрингс, который находится всего в 100 милях вглубь материка, средняя температура составляет от 55°F до 95°F. Объясните разницу в средних температурных диапазонах между этими двумя городами.4.
Хотя все ионы группы 1 имеют одинаковый заряд (+1), ионы Na + и K + избирательно переносятся через клеточные мембраны. Какую стратегию используют организмы для различения этих двух катионов?
Цель обучения
- Образец хлоридной соли щелочноземельного металла массой 0,156 г растворен в достаточном количестве воды для получения 20,5 мл раствора. Если осмотическое давление этого раствора составляет 2,68 атм при 25°C, то какова идентичность щелочноземельного металла?
Термическая буферная способность воды – одна из причин того, что человеческое тело способно выдерживать широкий диапазон температур. Какое количество тепла (в килоджоулях) необходимо для повышения температуры человека массой 70,0 кг с 37,0°C до 38,0°C? Предположим, что 70% массы тела составляет вода и что жидкости организма имеют такую же удельную теплоемкость, как и вода.
Во время болезни температура тела может повышаться более чем на 2°C. Одно из народных преданий гласит, что нужно “кормить лихорадку”. Используя данные таблицы 5.5 “Примерный состав и теплотворная способность некоторых распространенных продуктов питания”, сколько жареных куриных барабанных палочек нужно съесть человеку весом 70,0 кг, чтобы вызвать изменение температуры тела на 2,0°C? Предположим следующее: происходит полное преобразование калорийности курицы в тепловую энергию, 70% массы тела приходится исключительно на воду, а жидкости организма имеют такую же удельную теплоту, как и вода.
Водородная связь частично ответственна за высокую энтальпию испарения воды (Δ H
Из-за малых радиусов элементы второго периода имеют сродство к электрону менее отрицательное, чем можно было бы предположить, исходя из общих периодических тенденций. Когда электрон добавляется к такому маленькому атому, повышенное электрон-электронное отталкивание имеет тенденцию к дестабилизации аниона. Кроме того, малые размеры этих элементов не позволяют им образовывать соединения, в которых они имеют более четырех ближайших соседей. Таким образом, BF
= 43,99 кДж/моль при 25°C), что способствует охлаждению тела во время физических упражнений. Предположим, что бегун весом 50,0 кг выделяет 20,0 г пота во время бега, и весь пот превращается в водяной пар при температуре 37,0°C. Какое количество тепла выделится при этом? Какое количество тепла (в джоулях) отводится от кожи бегуна, если пот состоит только из воды?
Из-за малых радиусов элементы второго периода имеют сродство к электрону менее отрицательное, чем можно было бы предположить, исходя из общих периодических тенденций. Когда электрон добавляется к такому маленькому атому, повышенное электрон-электронное отталкивание имеет тенденцию к дестабилизации аниона. Кроме того, малые размеры этих элементов не позволяют им образовывать соединения, в которых они имеют более четырех ближайших соседей. Таким образом, BF
54)3322
2
Решение:
Все пять элементов группы 13 имеют валентную электронную конфигурацию ns 2 np 1, поэтому ожидается, что они образуют ионы с зарядом +3 в результате потери всех валентных электронов. Эффект инертной пары должен быть наиболее важным для самого тяжелого элемента (Tl), поэтому он, скорее всего, будет образовывать соединения в степени окисления, которая ниже на 2. Таким образом, для таллия, по прогнозам, наиболее важным будет состояние окисления +1.
эфф
Концептуальные проблемы
Расположите K, Cs, Sr, Ca, Ba и Li в порядке
Металл